Antes de abordar el tema de pigmentos fotosintéticos, es conveniente revisar la estructura atómica y molecular del carbono.
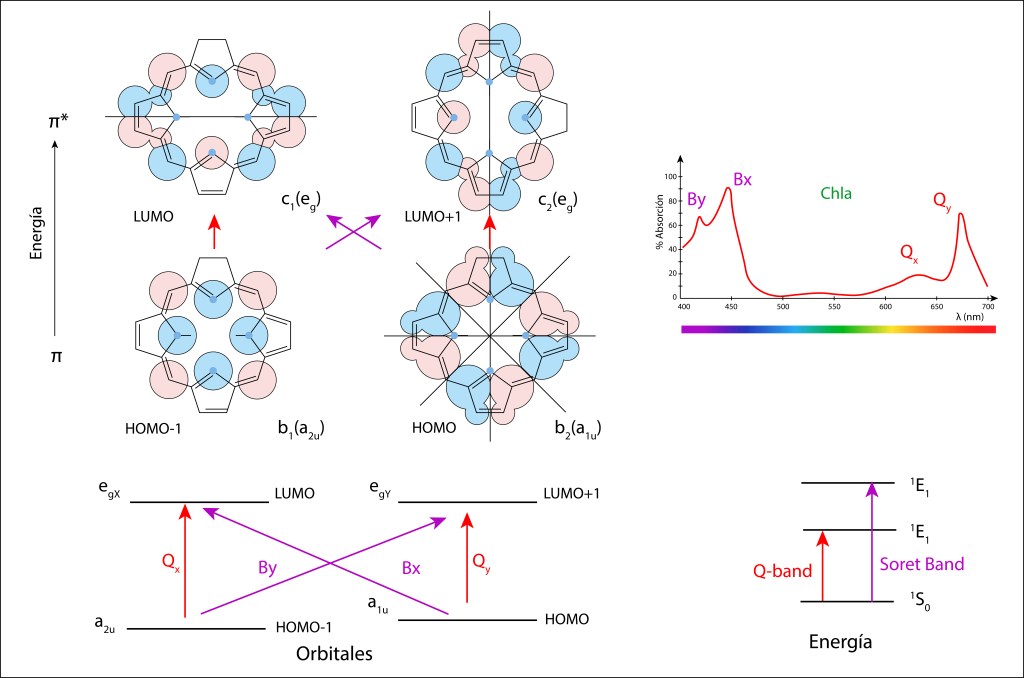
La Figura 1 ilustra de manera gráfica la distribución electrónica y los niveles de energía de los orbitales atómicos en el estado Ground y en los estados exitados sp3, sp2 y sp.
- Estado exitado sp3 : Los cuatro electrones porvenientes de los orbitales 2s y 2p se hibridizan en un nivel equipotente de energía intermedio entre los niveles 2s y 2p, conduciendo a cuatro electrones sp3 separados espacialmente 109,5° formando un tetraedro regular.
- Estado sp2 : Tres de los cuatro electrones se hibridizan de manera planar, separados 120° entre sí, quedando libre de hibridación el electrón 2pz cuya distribucion de probabilidad es perpendicular al plano sp3.
- Estado sp: , Solo dos electrones se hibridizan y sus distribuciones de probabilidad se ubican sobre el eje x. En este caso, los dos electrones, 2py y 2pz se distribuyen a 90° entre sí en un plano perpendicular al eje x.
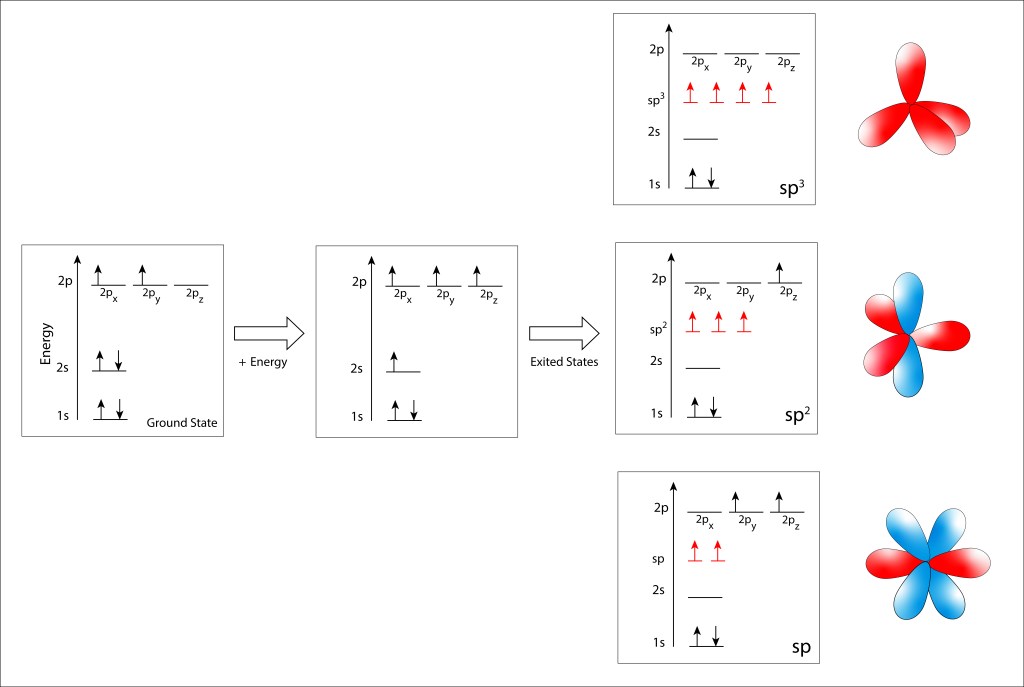
Figura 1. Orbitales atómicos Ground y exitados del átomo de carbono.
En los pigmentos fotosintéticos, Enlaces C=C alternan con enlaces C-C , sea de manera lineal (carotenos) o en anillo (clorofilas), formando lo que se denomina enlaces conjugados. Los enlaces C=C corresponden al estado exitado sp2 , en el que participan dos electrones: uno de los tres electrones híbridos sp2 y el electrón 2pz, ver Figura 2. Los dos electrones sp2 se alinean sobre un mismo eje, conformando un orbital molecular σ, mientras que los electrones 2pz se alinean de manera paralela, conformando un orbital molecular π.
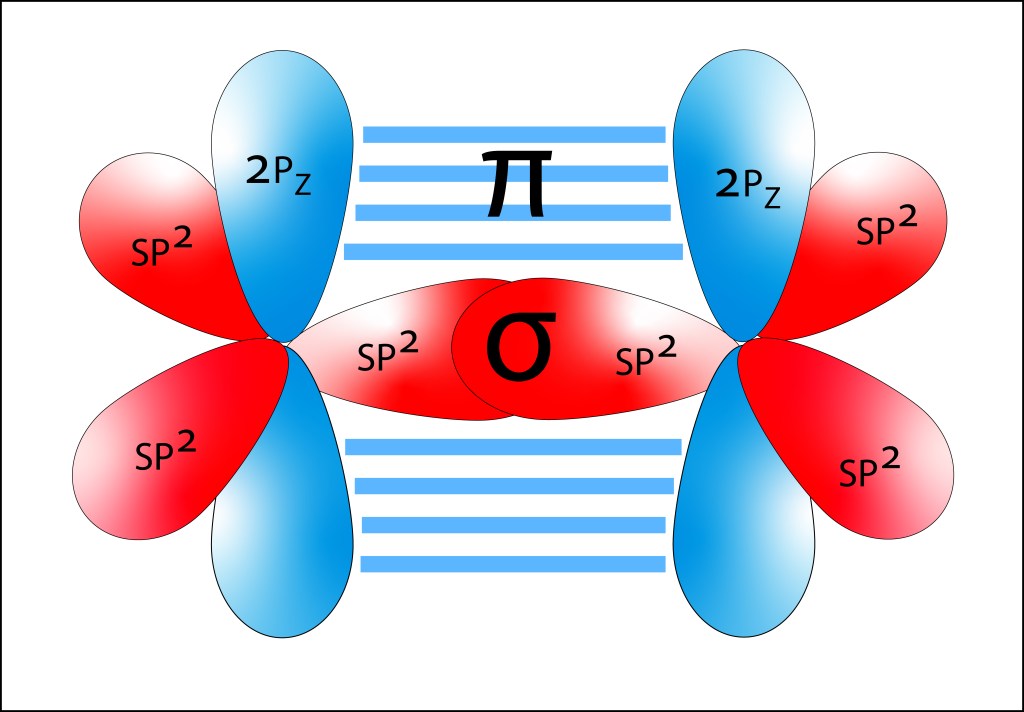
Figura 2. Orbitales moleculares para un enlace C-C correspondiente a sp2
Dependiendo del estado de fase, dos tipos de enlaces σ pueden presentarse: Bond, con funciones de onda en fase, y Antibond, con las funciones de onda desfasadas 180° entre sí, ver Fig 3.
Figura 3. Orbitales moleculares σ y σ* , Bond y Antibond, dependiendo de los estados de fase de los electrones participantes..
Orbitales moleculares tipo σ y σ* ocurren también entre orbitales atómicos px, ver Fig 4, mientras que py y pz interactuan de manera paralela conformando orbitales moleculares π y π*, ver Fig.5.
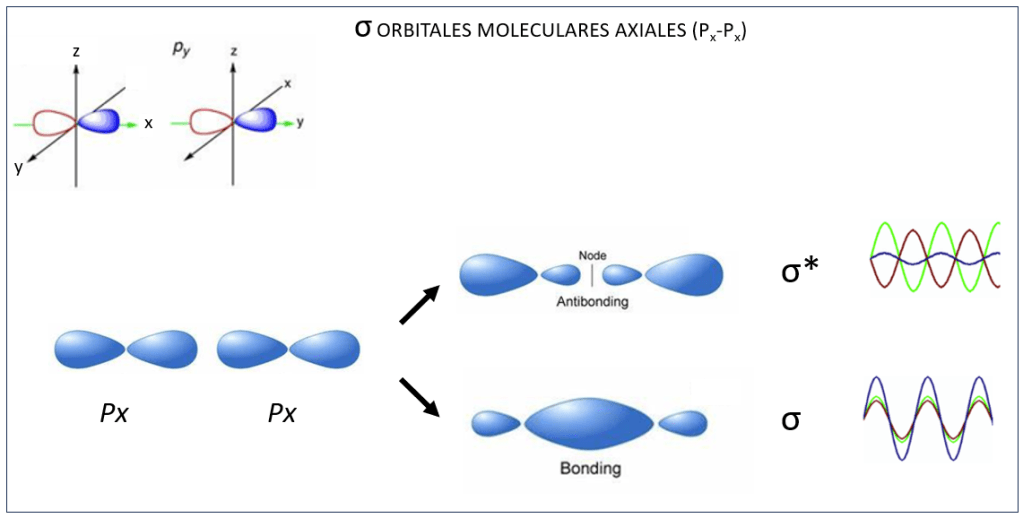
Figura 4. Orbitales moleculares σ y σ* entre orbitales atómicos Px
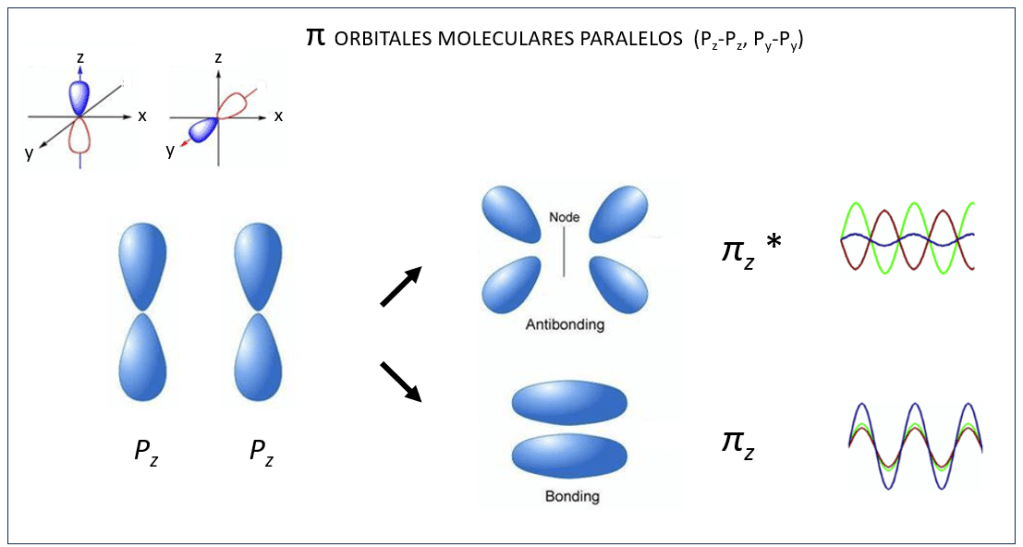
Figura 5. Orbitales moleculares π y π* entre orbitales atómicos py – py y pz-pz
La figura 6 describe los niveles de energía de los orbitales moleculares correspondientes a los elementos del grupo 2 de la tabla periódica.

Figura 6. Niveles de energía de los Orbitales moleculares para los elementos del grupo 2 de la tabla periódica.
Partiendo de los niveles de orbitales moleculares especificados en la fig.6., se dpuede definir el diagrama orbital molecular (MO Diagram) correspondiente al enlace C=C presente en los enlaces conjugados de los pigmentos fotosintéticos; ver Fig 7.
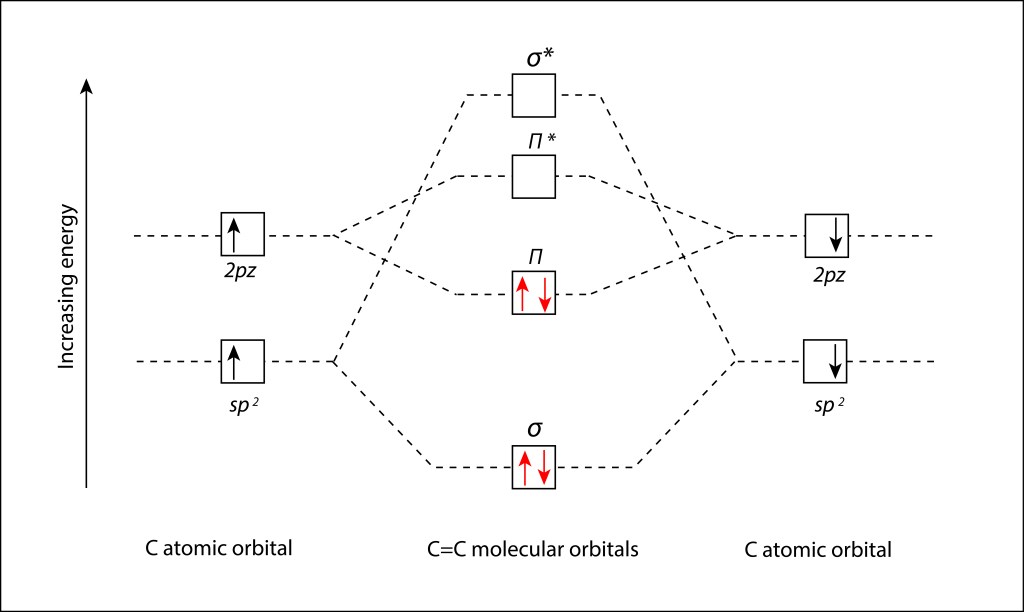
Figura 7. Diagrama orbital molecular (MO Diagram) para el enlace C=C en estado Ground
HOMO – LUMO
Los términos HOMO / LUMO hacen referencia a los orbitales “Highest Occupied Molecular Orbital” y “Lowest Unoccupied Molecular Orbital”, que, para el caso del enlace C=C especificado en la Fig.7., corresponden a los orbitales moleculares π y π*, respectivamente.
Se mencionó anteriormente que el orbital molecular π es un orbital “Bonding” en el cual las funciones de onda de los electrones que participan están en fase, ver Fig.5., mientras que π* es un enlace “Antibonding” , en desfase de 180°.
Cuando un fotón incide sobre un electrón π con un energía exactamente igual a la diferencia entre los niveles de energía (π* – π), en electrón se exita pasando del nivel π al π* , esto es, de HOMO a LUMO, ver Figura 8.

Figura 8. Diagrama orbital molecular (MO Diagram) para el enlace C=C en estado exitado
Los diagramas propuestos por Richard Feynman describen de una manera elegante la interacción fotón-electron, aplicable a los pigmentos fotosintéticos, ver Fig 9.

Figura 9. Diagrama de Feynman correspondiente a l salto de energía de un electrón π ground (HOMO) a su estado exitado π* (LUMO)
La exitación electrónica HOMO-LUMO de π a π* es el fenómeno natural al cual la vida a travez de la fotosíntesis ha recurrido para aprovechar la energía solar, con el único propósito de mantener su estructura y función orgánica, lo que viene a ser el motor mismo de la vida en nuestro planeta.
ESTADOS TRIPLETE Y SINGLETE
En adición a la energía de exitación inherente al tránsito HOMO-LUMO del electrón (π -> π*) , el momento angular del electron, denotado por S, o Spín, juega igualmente un rol importante en la captura de energía y relajación en los procesos fotosintéticos.
El Spin es un número cuántico inherente a las partículas que conforman el universo. En el caso de los fermiones, a los cuales pertenece el electrón, su valor siempre es S=1/2, y su proyección sobre el eje z, o sz , puede tomar los valores +1/2 (up ↑) y -1/2 (down ↓).
Matemáticamente,

Los dos eigenvalues de Sz, 


Para un sistema conformado por dos electrones, hay dos estados de importancia en los procesos fotosintéticos:
- Estado triplete: Comprende tres estados antisimetricos con spin total S=1
Componentes: ms=+1 , ms = 0 , ms −1, donde
∣T1⟩=∣↑↑⟩
∣T0⟩=1/√2 (∣↑↓⟩+∣↓↑⟩)
∣T−1⟩=∣↓↓⟩
- Estado singlete (S = 0): Estado simétrico con spin total S=0 .
Componente único : ms=0, donde
∣S⟩=1/√2(∣↑↓⟩−∣↓↑⟩)
Por regla general, para dos electrones en el mismo sistema, el estado singlete (estado simétrico) suele tener mayor energía que el estado triplete, debido principalemente a que un estado simétrico permite mayor cercanía entre el par de electrones que en estados antisimétricos, lo que aumenta la repulsión coloumbiana.
En la fotosíntesis y otros fenómenos bioquímicos, una e las estrategias de de-exitación se conoce como Inter-System Crossing, ISC. Electrones pueden pasar de estados Singlete de alta energía a estados triplete de menor energía, ver Fig. 10, como un paso intermedio para retorno a GND.

Figura 10. IC – ISC como rutas de De-exitación no radativa.
ENLACES CONJUGADOS
Como se mencionó, cadenas y anillos con alternancia de enlaces simples ( σ) y dobles (σπ) se denominan enlaces conjugados. ver Fig.11. En este tipo de arreglos, los electrones π se deslocalizan, lo que otorga una gran estabilidad a la molécula a mas de ser fenómeno base de sus propiedades resonantes.
La diferencia de energía (π* – π) en los pigmentos fotosintéticos depende de numerosos factores, intramoleculares e intermoleculares. Los enlaces conjugados, como parte de la estructura molecular, definen en buena medida el valor de dicha diferencia .

Figura 11. Estructura molecular de la porfirina, con un anillo conformado por 9 enlaces σπ alternando con 9 enlaces σ.
A mayor número de enlaces conjugados por pigmento menor la distancia energética (π* – π), lo que se traduce, en pigmentos fotosintéticos, a absorber fotones a menores energías, tan bajas como el infrarrojo cercano.
Cada grupo biológico dependiente de la fotosíntesis tiene su entorno característico, con una luminosidad característica, lo que implica que la maquinaria fotosintética debe sintonizarse con la fuente de energía disponible. El ajuste de la diferencia HOMO-LUMO es la herramienta base para dicha sintonización.
No quisiera cerrar esta lectura sin mencionar a un personaje que de una u otra manera entendió la importancia de la luz en el universo.
Me refiero al faraón Akhenaton, uno de los últimos faraones de la dinastía XVIII, quien en medio de un gobierno teocrático politeista se atrevió a implementar, por primera vez en la historia de la humanidad, el monoteismo en su reino. Así, el culto a Ra, el dios sol, se convirtió en el centro de la religión durante su regencia . Esta “herejía”, opuesta al zoológico de dioses defendidos por los sacerdotes de la época, marcó el principio del fín de su dinastía, quedando sin embargo “grabado en piedra” para la posteridad su aporte al reconocimiento del papel de la energía electromagnética, entiendase Ra, sol, luz o fotón, en la vida y evolución de nuestro planeta.
Obviamente, tras Akhenaton vinieron aportes menos religiosos y más científicos, dentro de los que cabe resaltar los aportes de J.C. Maxwell, Max Plank , Albert Einstein y Richard Feynman, entre otros, pero eso debería ser tema para otras lecturas.