
Una molécula de clorofila es el más pequeño y preciso “violín” diseñado por la naturaleza.
Su función resonante es equivalente a la de un instrumento musical de cuatro cuerdas, incluyendo en su estructura una “caja de resonancia”, cuatro “cuerdas vibrantes” y un conjunto variado de “clavijas de afinación”.
3,500 millones de años en investigación y desarrollo (R&D) en nanotecnología dieron como resultado la pieza molecular resonante más eficiente y de mayor trascendencia para la vida en el planeta.
La Clorofila posee una estructura tetrapirrólica derivada de la Clorina (Porfirina parcialmente reducida), ver Fig 1., caracterizada por contener una larga cadena de enlaces conjugados (18 o más enlaces 𝞼, 𝝿) , que les otorgan a la molécula sus propiedades resonantes y sus particulares espectros de absorción lumínica.

Fig 1. Estructura tetrapirrólica de la Clorina
En el caso de Bchl a, con dos anillos parcialmente reducidos, los enlaces conjugados (18 enlaces alternos 𝞼, 𝝿), ver Fig. 2, generan en la molécula unas frecuencias de exitación LUMO – HOMO particularmente bajas, correspondientes al espectro visible o incluso en el infrarojo cercano. La deslocalización electrónica es responsable de sus propiedades resonantes, convirtiendo al anillo en una verdadera “caja de resonancia molecular”, siendo las frecuencias de exitación electrónica inversamente proporcionales a la longitud de las cadenas conjugadas.

Fig 2. Bacterioclorofila a : Estructura molecular
En adición al macrociclo tetrapirrólico, clorofilas y bacterioclorofilas contienen dentro de sus estructura:
- Un ión Mg2+ , coordinado en el centro de la molécula por los nitrógenos pirrólicos, el cual estabiliza la molécula, manteniendo la estructura planar característica de estos compuestos semi-aromáticos. Desde el punto de vista funcional, Mg2+ contribuye a los valores de exitación molecular.
- Un quinto anillo (Ciclopentano), ubicado entre los pirroles III y IV (anillo V), limita la función planar del ión Mg2+ , otorgándole a la molécula una cierta curvatura. Adicionalmente, contribuye a los valores finales de los coeficientes orbitales moleculares, en consecuencia a la distribución electrónica molecular.
- Radicales funcionales, que contribuyen a la hidrofobicidad molecular (CH3), al desplazamiento de absorción lumínica por electronegatividad (-CHO y -COOH) y a los valores finales de conjugación y absorción (–CH=CH₂).
- Una cadena de fitol (alcohol diterpénico esterificado en el pirrol IV) hidrofóbico, el cual ancla la clorofila a la membrana, incrementa la solubilidad molecular en ambientes lipídicos, orienta la molécula adecuadamente para favorecer la absorción lumínica. En complejos antena contribuye al posicionamiento intermolecular para garantizar la transferencia energética vía Resonancia de Förster.
En resumen, los espectros de absorción en clorofilas dependen de la acción conjunta de la estructura conjugada del anillo tetrapirrólico, del magnesio coordinado, del ciclopentano, de los radicales asociados, e incluso del entorno electromagnético circundante , dando como resultado una “afinación” final del espectro de absorción (exitación energética) característica para cada tipo de molécula. Estos elementos, pero en particular los radicales, se convierten en las “clavijas de afinación” de este maravilloso instrumento de cuerdas, definiendo lo que musicalmente podría equivaler a una afinación bién temperada, ajustada en cada caso a la oferta energética particular presente en cada entorno ecológico, lo que contribuye de manera muy significativa a la diversidad de las especies fotosintéticas y de la vida en el plateta.
LAS CUERDAS VIBRANTES
En 1961, Martin Gouterman propuso un modelo que explicó adecuadamente el espectro de absorción de las porfirinas, basado en la existencia de cuatro orbitales moleculares.
De acuerdo al modelo, las bandas de absorción lumínica dependen de las trancisiones electrónicas entre dos orbitales HOMO y dos LUMO, ver fig 3., donde las energías de transición LUMO-HOMO son afectadas por Mg2+ y los radicales funcionales electronegativamente cargados, especialmente -CHO y -COOH.
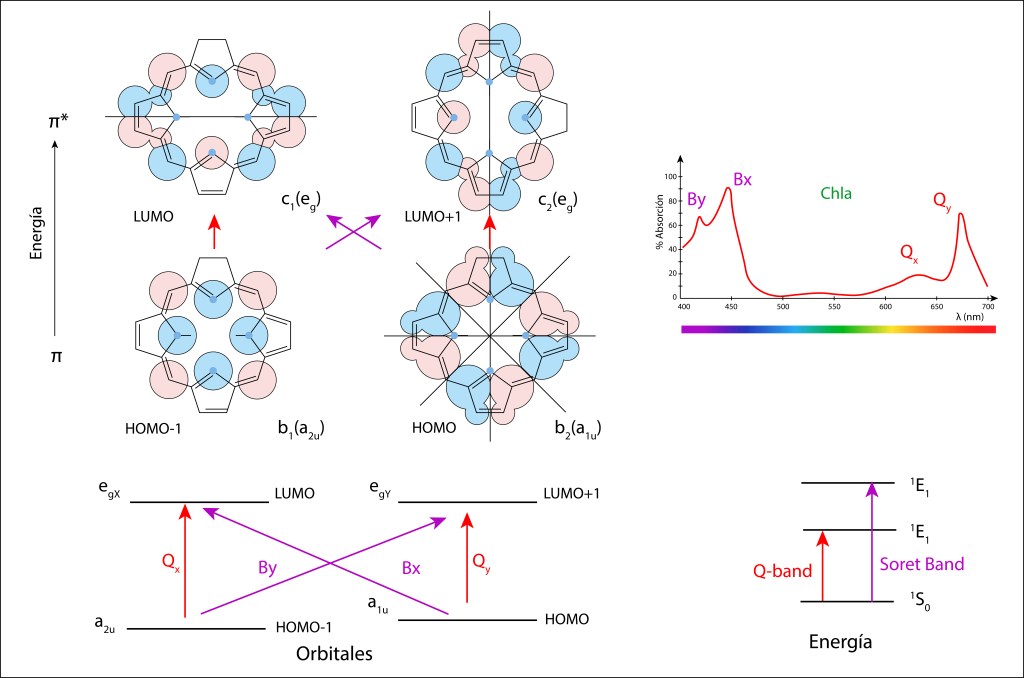
Fig 3. Modelo de cuatro orbitales moleculares de Gouterman
Las cuatro configuraciones moleculares corresponden a los cuatro orbitales de Gouterman, los círculos azules y rojos representan los coeficientes orbitales atómicos, calculados a partir de la función de Schrödinger, de tamaño proporcional a su aporte a los valores finales de loscoeficientes de los orbitales moleculares, y el color de los círculos asu fase , 0° o 180°.
Las transiciones HOMO -> LUMO pueden ser directas, bandas Q en el espectro de absorción, ver Fig 3., o cruzadas, banda de SORET, en el azul o UV cercano.
De manera que los cuatro orbitales de Gouterman vienen a ser los equivalentes de las cuerdas vibrantes de nuestro pequeño instrumento musical.
Se debe aclarar que los orbitales LUMO son orbitales degenerados, con idéntico nivel energético, lo que conduce a una sola banda B.
LA LUZ HECHA MÚSICA
Las frecuencias correspondientes a las longitudes de onda indicadas en el espectro de absorción de la Fig 3. pueden calcularse a partir de la relación:
F = C/𝝺
Donde C es la velocidad de la luz y lambda (𝝺) la longitud de onda.
Con propósitos púramente comparativos, y sin pretender con esto unificar bajo un mismo fenómeno físico ondas electromagnéticas y ondas sonoras, es posible determinar las notas y octavas en las cuales se ubicarían los picos de absorción de la bacterioclorofila a (Bchl a), si dichas frecuencias correspondieran a ondas de sonido.

Fig 3. Notas musicales y octavas correspondientes a los picos de frecuencias de absorción de Bchl a .
Octavas 40, 41 y 42 !!!
Se requería un piano con un teclado de algo mas de siete metros de longitud para obtener dichas notas !!!
Este conjunto particular de notas (B, C#, D# y F#) no corresponde a ningún acorde clásico, ni mayor ni menor, si bién pertenecen a la escala de C# mayor, de manera que podrían utilizarse en la composición de piezas musicales en dicho tono, o construir un acorde suspendido para música moderna o Jazz, aunque sería un jazz imposible de escuchar con nuestro oído, dada su altísima frecuencia. Debemos conformarnos con escucharlas con nuestros ojos.
Como ondas electromagnéticas, las frecuencias de la octava 42 corresponden al violeta cercano y azul, mientras que las frecuencias de la octava 40 se ubican en el rojo.
CONCIERTO PARA DOS VIOLINES
Finalmente, aunque el tema merece un blog aparte, el fenómeno de la fotosíntesis implica no solo una transición electrónica de HOMO a LUMO en una molécula de clorofila, sino una liberación del electrón exitado para iniciar la cadena de transporte de electrones, ETC, elemento fundamental del proceso fotosintético.
Esta transición solo es viable en emparejamientos planares especiales de dos moléculas de clorofila que vienen a conformar una única unidad funcional, denominada “Special Pair”, ver Fig 4, la cual se ubica en el Centro de Reacción del aparato fotosintético.
La reducida distancia interplanar permite que se compartan los electrones 𝝿 de los enlaces conjugados de las dos moléculas, lo que modifica sensiblemente la respuesta exitatoria al punto de poderse liberar un electrón a partir de frecuencias exitatorias tan bajas como la banda Q , o incluso, en algunas bacterias del fondo oceánico, en bandas correspondientes al IR cercano.

Fig 4. CHla. Par especial.
Gracias a este “Concierto para dos violines”, la luz se hace materia.
La mejor analogía que encuentro para este maravillos fenómeno lo resumo en la siguiente imagen de Miguel Angel, con la cual concluyo el presente blog.

Orlando Rodríguez
M. Sc
