Aunque las arqueas se separaron evolutivamente de las bacterias hace al menos 3,000 – 3,200 millones de años, las bases de sus mecanismos de captura y transporte de energía se han conservado invariantes.
Así, el acoplamiento quimiosmótico entre un aparato generador de fuerza protomotiz (PMF) mediante bombeo de protones del interior hacia el exterior de la célula, y un complejo proteico (ATP-Synthase), diseñado específicamente para aprovechar este tipo de energía y acumularla en forma de ATP , son el común denominador para ambos grupos biológicos, si bien difieren de manera absoluta en la estructura y operación del complejo generador PMF.
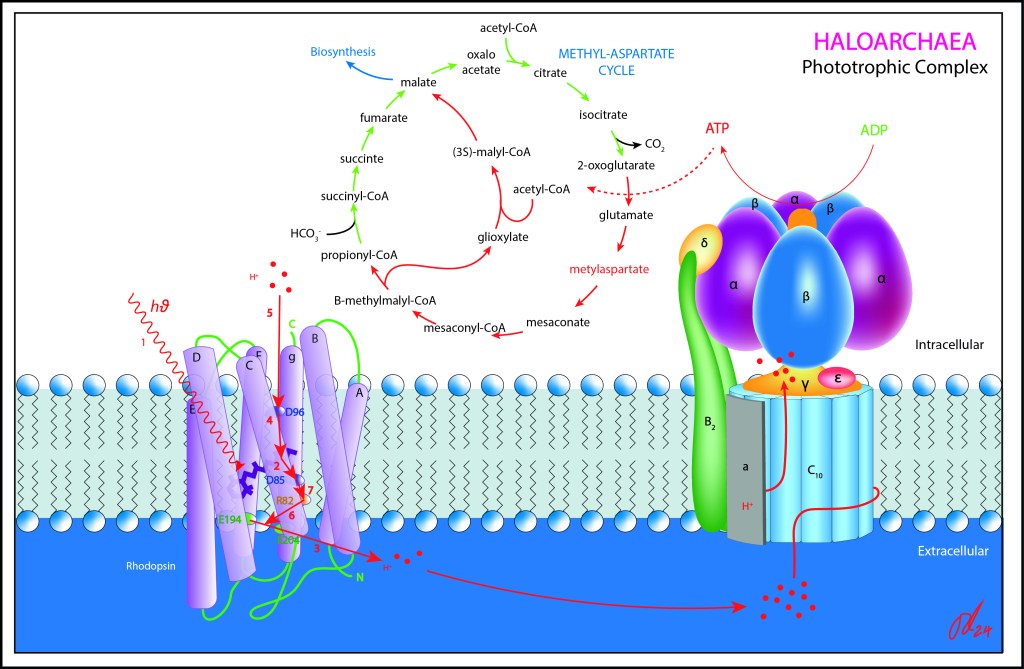
En arqueas, este complejo, denominado Bacteriorhodopsina BR, forma parte de un extenso arsenal de rhodopsinas presentes en arqueas, todas activadas por energía lumínica, grupo que incluye además las Halorhodopsinas HR (transporte hacia el citoplasma de iones Cl-) , Channelrhodopsinas CR (transporte Na+, K +, Ca2+, H+) , así como rhodopsinas sensoriales (SR) destinadas a orientar a las células hacia las fuentes de luz.
En general, todas las rhodopsinas son proteinas 7-transmembrana con retinal como cofactor, pero a diferencia del retinal presente en nuestros ojos, la luz isomeriza de un estado all-Trans a 13-Cis .
En BR, esta fotoisomerización genera a su vez un cambio conformacional al interior de la proteina, modificando la distribución de cargas eléctricas, particularmente en los aminoácidos D96, D85 , R82 y en el complejo Glu 204-Glu194 en la frontera externa de la proteína, convirtiendose estos elementos en receptores/dadores intermediarios del transporte de iones H+.
De esta manera, el nuevo estado eléctrico generado por lo isomerización del retinal, guía de manera controlada el transporte activo de protones desde el citoplasma hacia el exterior de la célula, generando finalmente un gradiente H+ (PMF), a ser aprovechado por la ATP syntasa.

El transporte de protones desde el citoplasma hacia el exterior de la célula no sigue una secuencia espacial dentro de la proteína, de manera que los movimientos parciales se dan “en desorden”, activandose primero D85 central (M1), luego PCR ubicado en frontera exterior, luego RSB y D96 interiores para finalmente concluir cerrando el ciclo R82 externo.
Este aparente desorden evita el tránsito iónico en sentido contrario, Back Propagation dirían los amantes de la inteligencia artificial, de los iones H+, optimizando así la eficiencia PMF.
Para garantizar la concentración iónica, el aparato fototrófico se ubica en invaginaciones de la membrana celular, lo que garantiza el confinamiento de carga H+ requerido para generar la diferencia de potencial a ser aprovechada por ATP Synthase .
Esta estrategia de confinamiento de cargas mediante invaginaciones de membrana se repite de manera casi que invariante en los diversos complejos fotosintéticos presentes en algas y plantas superiores, en membranas de bacterias fotosintéticas y también en los complejos fosforilativos presentes en las mitocondrias.
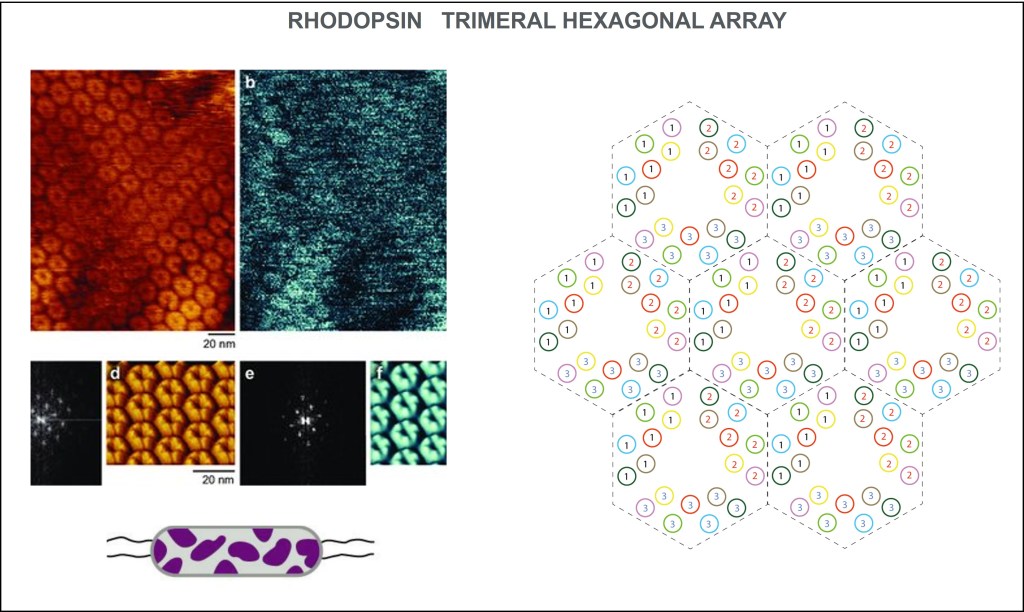
SIMETRÍA TRIGONAL-HEXAGONAL
La distribución de rhodopsinas en la membrana celular obedece a unos arreglos geométricos en tripletas moleculares conformando hexágonos a manera de panal, lo que optimiza el aprovechamiento de la superficie de membrana.
El proceso de aprovechamiento de luz para generación de PMF en arqueas es un proceso fototrofico, no fotosintético, lo que quiere decir que el carbono es incorporado al metabolismo celular a partir de moléculas parcialmente reducidas (HCO3-) y nunca (al menos en lo observado hasta el momento) a partir de CO2.
En arqueas, el ciclo del Metil-Aspartato es la ruta reductora preferente, utilizando como fuente de energía el ATP generado por la ATP Synthase, y generando malato como punto de partida para numerosas rutas de biosíntesis celular.
Orlando Rodríguez
Juno 2025
LECTURAS RECOMENDADAS
Evolución de las Arqueas
Adam PS, Borrel G, Brochier-Armanet C, Gribaldo S. The growing tree of Archaea: new perspectives on their diversity, evolution and ecology. ISME J. 2017 Nov;11(11):2407-2425. doi: 10.1038/ismej.2017.122. Epub 2017 Aug 4. PMID: 28777382; PMCID: PMC5649171.
Bacteriorhodopsinas
Yizhar O, Fenno L, Zhang F, Hegemann P, Diesseroth K. Microbial opsins: a family of single-component tools for optical control of neural activity. Cold Spring Harb Protoc. 2011 Mar 1;2011(3):top102. doi: 10.1101/pdb.top102. PMID: 21363959.
Ernst OP, Lodowski DT, Elstner M, Hegemann P, Brown LS, Kandori H. Microbial and animal rhodopsins: structures, functions, and molecular mechanisms. Chem Rev. 2014 Jan 8;114(1):126-63. doi: 10.1021/cr4003769. Epub 2013 Dec 23. PMID: 24364740; PMCID: PMC3979449.
Rhodopsinas sensoriales
Sasaki J, Takahashi H, Furutani Y, Kandori H, Spudich JL. Sensory rhodopsin-I as a bidirectional switch: opposite conformational changes from the same photoisomerization. Biophys J. 2011 May 4;100(9):2178-83. doi: 10.1016/j.bpj.2011.03.026. PMID: 21539785; PMCID: PMC3149258.
