La convergencia evolutiva de los fotosistemas PSI y PSII ha sido sin lugar a dudas la innovación bioquimica de mayor impacto en la historia de vida en nuestro planeta.
Esta trascendental propuesta, desarrollada hace algo más de 2,500 millones de años por las cyanobacterias y luego transmitida por endosimbiosis seriada hacia algas y plantas superiores, permitió extraer del agua los electrones requeridos para mantener en funcionamiento la maquinaria fotosintética, llevandola a un nivel de eficiencia que terminó redireccionando el curso evolutivo de la vida.
El precio de dicha innovación fué muy alto.
El oxígeno liberado durante el proceso de oxidación del agua se convirtió en una amenaza para la vida, e incluso en una amenaza para la misma maquinaria que lo generó, lo que implicó involucrar una serie de rutas de protección de la maquinaria fotosintética, ver Fig 1.
Bajo condiciones ideales, y con un aparato fotosintético produciendo justo lo requerido, el oxígeno residual no es realmente una amenaza.
Pero variaciones en la disponibilidad de luz, cambios en PH, temperatura y humedad, restricciones en el acceso a CO2 , etc, implican cambios en los balances de las reacciones de oxidoreducción.
En estos casos, la oferta de electrones generados puede llegar a superar la capacidad de consumo por parte de la misma, lo que resulta en una cadena de trasporte de electrones ETC altamente reductora.
Bajo estas condiciónes, la probabilidad de generarse especies reactivas de oxígeno ROS, es muy alta, exponiendo a PSI y PSII a daños severos. La síntesis de especies reactivas del oxígeno y los orbitales moleculares correspondientes a las mismas se resumen en las Fig 1 y Fig 2.
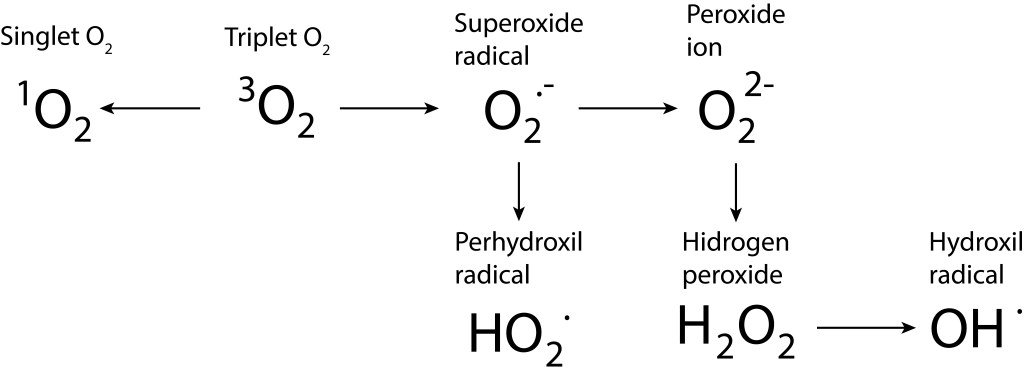
Figura 1. Rutas de formación de especies reactivas de oxígeno.
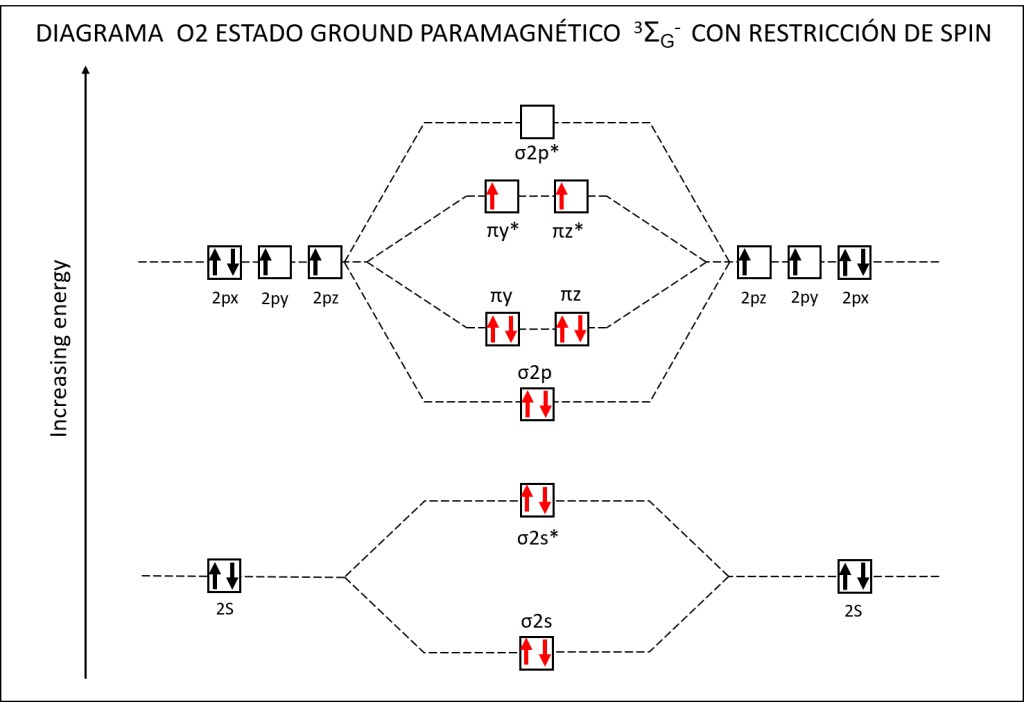
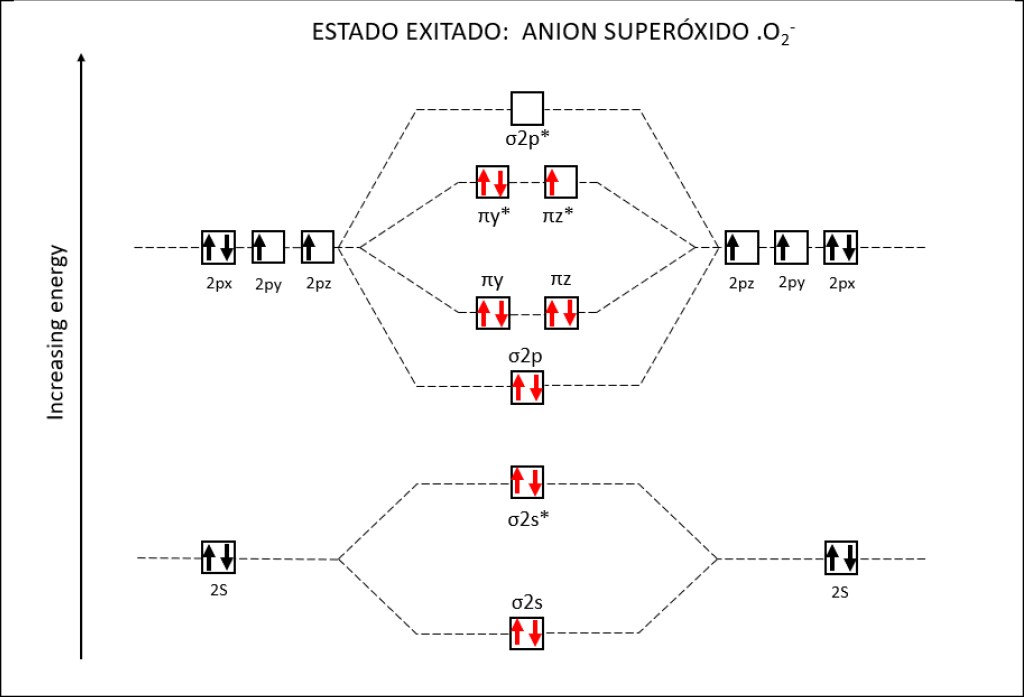
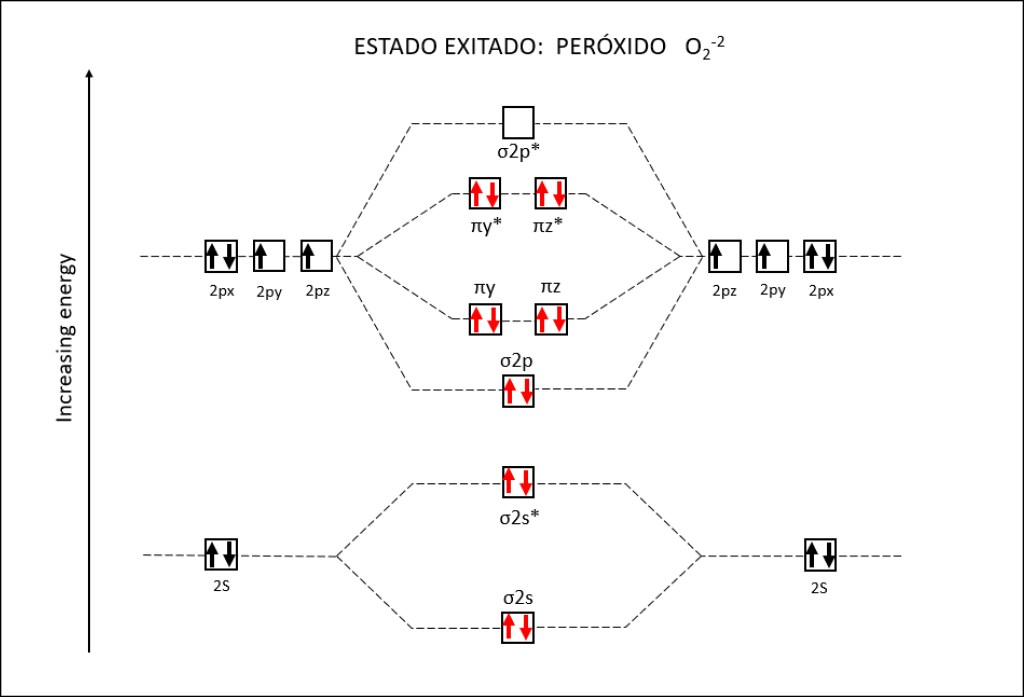
Figura 2 : Orbitales moleculares correspondientes al estado ground y a los estados exitados superóxido y peróxido de la molécula de oxígeno.
La generación de radicales hydroxil se dá por dos vías principales:
- Por acción de la luz UV , que disocia H2O2 a su forma 2 OH.
- En presencia de Fe(II), en la reacción de Fenton:
Fe2+ + H2O2 → Fe3+ + OH. + OH–
Los radicales hydroxil son extremadamente reactivos, responsables del estrés oxidativo y causantes del daño no solo de los fotosistemas sino en general del entorno celular.
Mientras PSII tiene una capacidad de respuesta regenerativa relativamente alta ante la acción de especies reactivas, PSI es mucho más sensible a daños definitivos, exponiendo a la maquinaria global a colapsar en su función.
PROTECCIÓN ROS
La generación de especies reactivas de oxígeno hace necesario contar con rutas bioquimicas de control que permitan mantener el entorno fotosintético en estado oxidado, ver Fig 3.
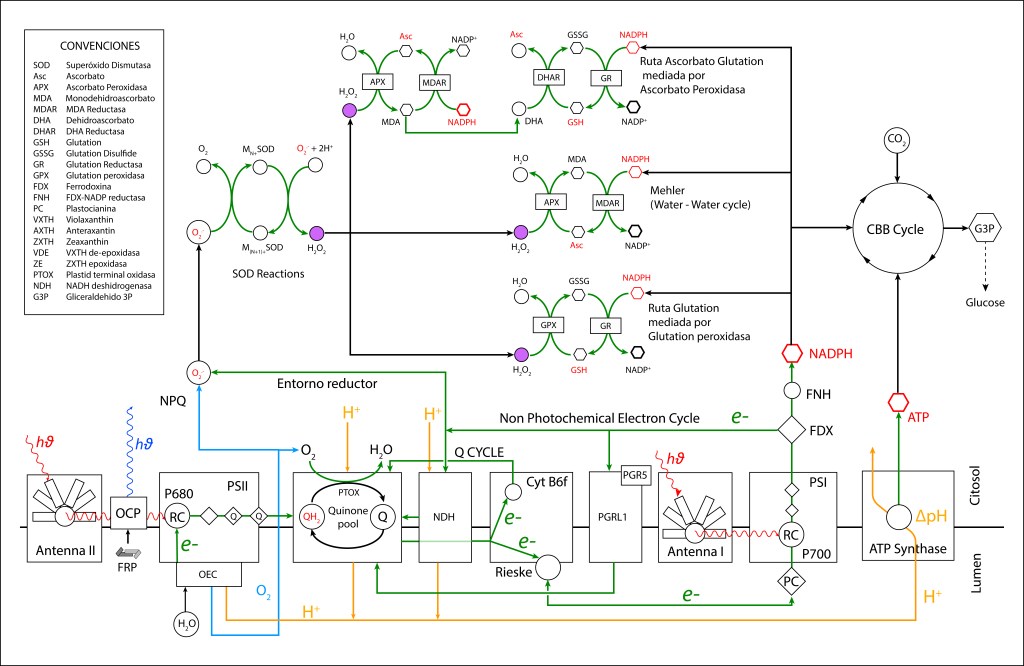
Figura 3. Rutas NPQ y protección ROS presentes en la maquinaria fotosintética de cyanobacterias.
Las rutas de control ROS pueden clasificarse en dos tipos:
- RUTAS PREVENTIVAS: Actúan sobre entornos reductores redireccionando el flujo de electrones hacia pool de quinonas para luego extraerlos por agentes oxidantes específicos.
- RUTAS CORRECTIVAS: Actúan reduciendo las especies ROS generadas.
RUTAS PREVENTIVAS ROS
- RUTA PTOX MEDIADA POR NDH-1
PTOX Deriva su nombre de la enzyma “Plastid Terminal Oxidase”, o“Plastoquinol Terminal Oxidase“, la cual reside adyacente a la membrana thylakoide.
Esta enzima actúa como válvula de seguridad, extrayendo electrones del pool de quinonas mediante la reacción
PQH2 + O2 → 2 PQ + 2 H2O
PQ es reducido a su forma PQH2 mediante un flujo cíclico de electrones (Non photochemical electron cycle) provenientes de FDX– siguendo la ruta
FDX– → NDH-1 → PQ → PQH2
NDH-1 corresponde al complejo proteico transmembrana NADPH dehydrogenasa presente en cyanobacterias, es responsable de la oxidación de FDX– y de la correspondiente reducción de PQ.
La transferencia de electrones en la ruta PTOX se conoce como “Clororespiración” y se puede resumir asi:
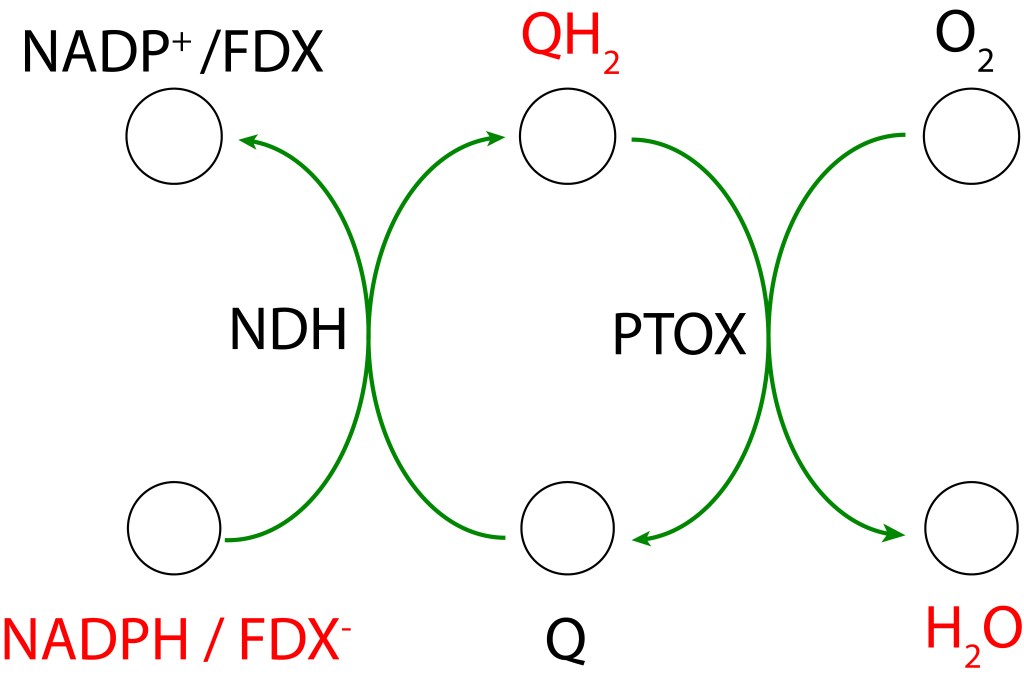
La ruta se activa, entre otras causas, cuando la disponibilidad de CO2 citoplasmatico no es lo suficientemente alta como para atender los requerimientos del ciclo de Calvin Benson. Bajo esta condición, la caída en concentración de CO2 desacelera el ritmo del ciclo CBB generando un represamiento de las especies NADPH y FDX– , lo que promueve un entorno reductor favorable a la formación de especies ROS, particularmente por FDX– , cuyo alto represamiento puede terminar transfiriendo electrones a O2 generado las especies ROS mencionadas.
Para prevenir esta condición, las rutas PTOX reenrutan los electrones hacia el pool de quinonas Se ha reportado que la acción de PTOX es responsable hasta del 30% del drenaje de electrones en el tráfico ETC (Zolotereva et.al. 2022).
La acción colaborativa PTOX/NDH-1 actúa sobre FDX– “aguas abajo” de PSI y Cyt b6f permitiendo que bajo condiciones de stress, la síntesis de ATP se mantenga intacta, lo que hace de este esquema de protección un mecanismo altamente eficiente para la función general fotosintética.
NDH-1 participa en el bombeo de protones al lumen durante la transferencia electrónica de manera equivalente al complejo I mitocondrial y al NDH presente en plantas y algas verdes, contribuyendo a incrementar la fuerza protomotriz ΔpH , lo que aumenta la eficiencia energética del sistema.
- RUTA PTOX MEDIADA POR PGRL1-PGR5
La proteína transmembrana PGRL1 (Proton Gradient Regulation Like 1) es una proteína reguladora transmembrana de bajo peso molecular, presente en cyanobacterias, plantas y algas verdes.
PGRL1 actúa en conjunto con la proteina PGR5 (Proton Gradient Regulation 5), conformando un heterodímero con función equivalente a la de NDH-1.
La velocidad de respuesta del heterodímero ante variaciones en concentración FDX– es mucho mayor que la de NDH-1, lo que permite que las dos proteínas actúen de manera complementaria para el funcionamiento óptimo de PTOX. Adicionalmente, mientras PGRL1 opera en condiciones de alta intensidad lumínica, desempeñando una función fotoprotectora, NDH-1 se activa en condiciones de baja luminosidad o bajo stress prolongado.
En resumen, NDH-1 y PGRL1 actúan rediraccionando“de manera preventiva” el flujo de electrones de FDX– hacia el pool de quinonas generando un flujo cíclico electrónico no fotoquímico que contribuye a mantener en estado oxidado el entorno PSI , minimizando por esta vía la generación de especies ROS. Ambas rutas habilitan la función de drenaje PTOX, con H2O como depositario final de electrones y oxígeno provenientes del sistema.
RUTAS CORRECTIVAS ROS
Actúan reduciendo H2O2 a H2O mediante peroxidasas específicas, controlando los niveles ROS en citosol y membrana thylakoide.
Previa la activación de las rutas de control, radicales superóxido O .−2 deben ser convertidos en H2O2 y O2 mediante la acción de Superóxido dismutasas, SOD, en la siguiente reacción simplificada:
O .−2 + O .−2 + 2H+ → O2 + H2O2
SOD corresponde a una familia de metaloenzimas antioxidantes cruciales a la salud celular presentes en archaeas, bacterias y eukariotas que, dependiendo del metal o metales coordinados, se clasifican en los siguientes grupos:
- FeSOD : Presente en citosol
- MnSOD: Asociada en cyanobacterias y plantas a membrada thylakoide en vecindad a PSII
- Cu/ZnSOD: Presente en citosol
- NiSOD: presente en cytosol. (Exclusivo de prokariotas)
La reacción comprende dos etapas:
Etapa de reducción del metal coordinado, oxidando O .−2 a O2 :
M(n+1)+−SOD + O .−2 → Mn+−SOD + O2
Etapa de reoxidación del metal coordinado, reduciendo O−2 a H2O2 :
Mn+−SOD + O−2 + 2H+→ M(n+1)+−SOD + H2O2
El estado de oxidación del catión metálico evoluciona entre n+1 → n → n+1:
- (Cu2+ → Cu+ → Cu2+)
- (Mn3+ → Mn2+ → Mn3+)
- (Fe3+ → Fe2+ → Fe3+)
- (Ni3+ → Ni2+ → Ni3+)
Una vez convertido O−2 en H2O2 por SOD, tres rutas contribuyen al control ROS mediante la reducción de H2O2 a H2O, teniendo como factor común la cesión inicial de electrones a partir de NADPH.
- REACCIÓN DE MEHLER (CICLO AGUA-AGUA)
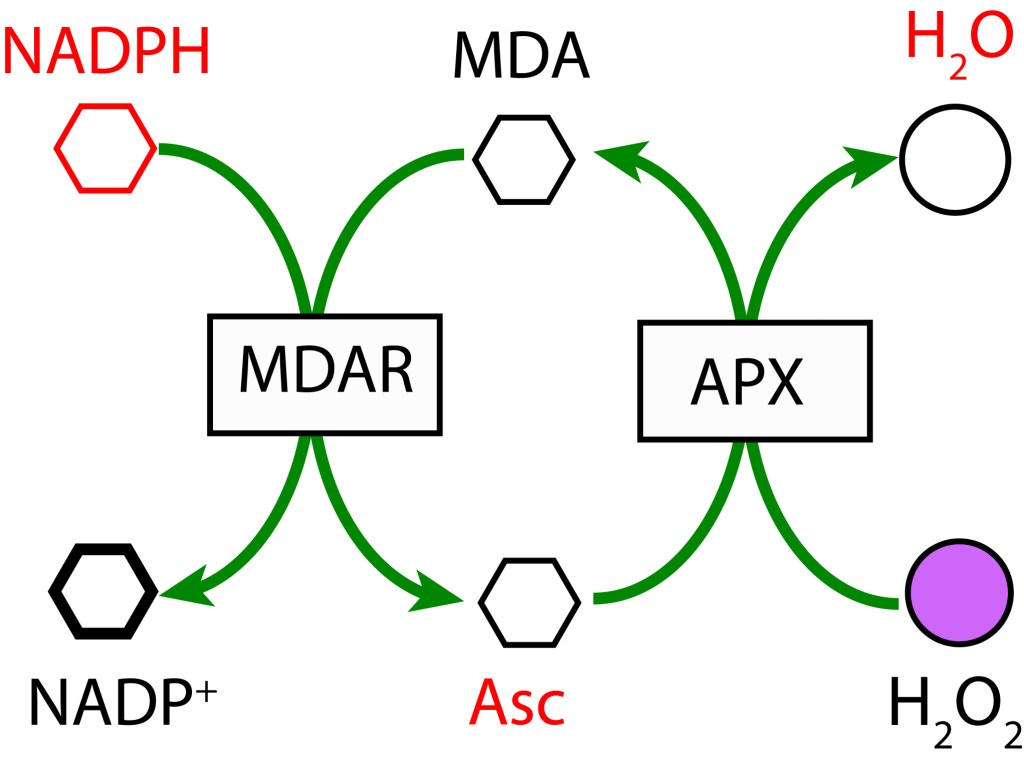
La reacción de Mehler, conocida también como ciclo agua-agua (WWC), está presente en todos los organismos con fotosíntesis oxigénica y presencia de fotosistema PSI.
En un primer paso, MDA (Monodeshidroascorbato) se reduce a Ascorbato (ASC) usando NADPH como donante de electrones mediante la enzima MDAR (MDA Reductasa). En la etapa final MDA se regenera mediante la enzima Ascorbato Peroxidasa y transferencia de electrones al Peróxido de Hidrógeno para formar agua.
Aunque el ciclo se conoce como ciclo Agua-Agua, referido a que la fuente primaria de los electrones es agua (proveniente del ciclo de KOK), y que el producto final de la ruta también es agua, esta condición es común para las tres rutas correctivas.
RUTA ASCORBATO GLUTATION MEDIADA POR ASCORBATO PEROXIDASA
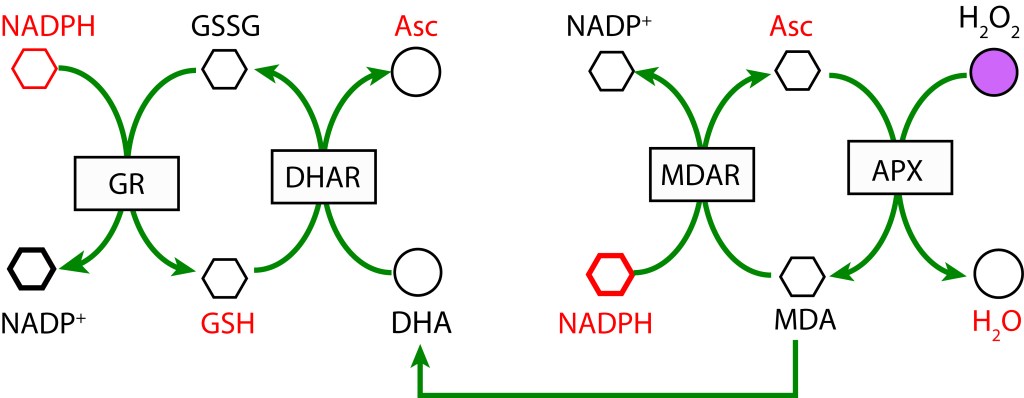
La ruta es activada tras la reducción de MDA (Monodehidroascorbato) a Ascorbato utilizando la enzima MDAR (Monodehidroascorbato reductasa) con NADPH como donador de electrones. MDA es regenerado mediante la acción de la enzima Ascorbato peroxidasa (APX) resultando en la reducción de H2O2 a H2O. Como radical, si no se favorece una rápida reducción, MDA dismuta a Ascorbato y Dehidroascorbato (DHA) .
En una segunda cadena de oxidoreducción, Dehidroascorbato se reduce a Ascorbato mediante la enzima Dehidroascorbato reductasa (DHAR), utilizando Glutatión (GDH) como agente reductor, el cual se oxida a su forma Glutatión disulfido (GSSG). Finalmente, GSH se regenera con NADPH como donor de electrones y la acción de la enzima Glutatión reductasa (GR).
ROL DEL ASCORBATO
ASC (forma salina dedl ácido Ascórbico, o Viamina C), es el principal antioxidante de cyanobacterias y plantas superiores. En adición a su función durante la fotosíntesis, participa como señalizador durante el proceso de la mitosis, forma parte del control de la función meristemal, contribuye al crecimiento radicular en plantas e interviene en la activación de la floración y durante la senecencia vegetal.
Cuatro rutas de síntesis de Ascorbato han sido descritas en plantas, con D-Glucosa, Myo-Inositol y pectinas de la pared celular como precursoras.
- RUTA GLUTATION MEDIADA POR GLUTATION PEROXIDASA
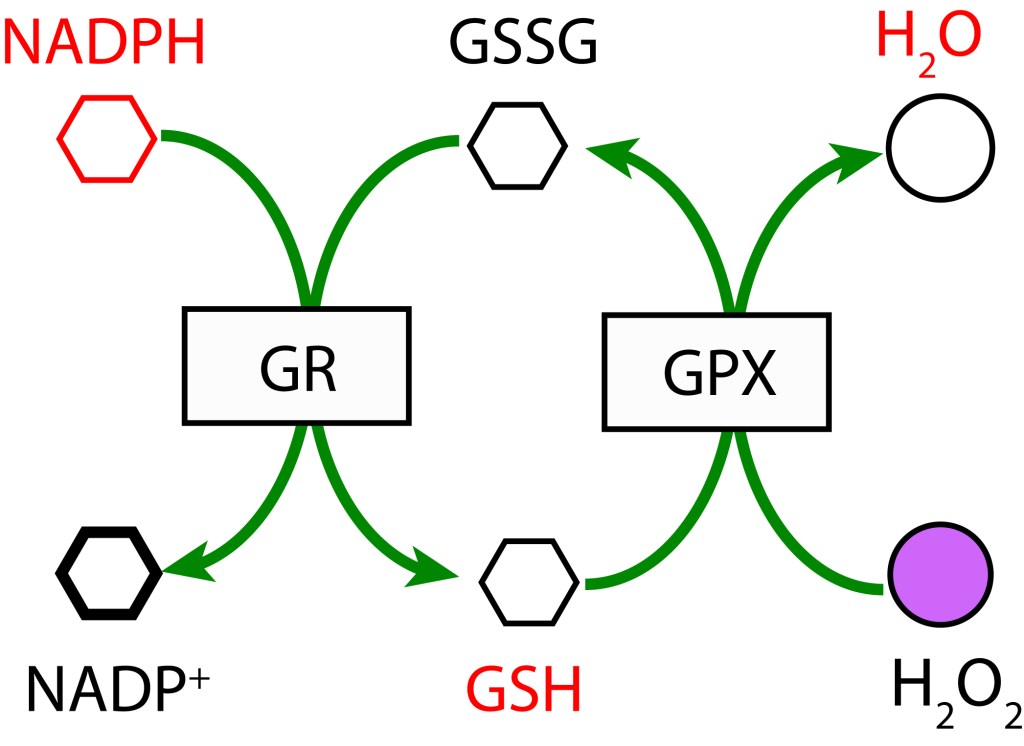
En esta ruta, GSH participa como agente reductor actuando sobre H2O2 para producir H2O mediante la enzima Glutation Peroxidasa (GPX). GSH es regenerado a partir GSSG con NADPH como donor de electrones bajo la acción de la enzima Glutatión Reductasa (GR).
NPQ (NON PHOTOCHEMICAL QUENCHING)
Las rutas de protección expuestas previamente corresponden a protección electrónica de alta energía, presente en especies reactivas ROS.
Existe adicionalmente una ruta de protección fotónica equivalente en función al ciclo de Xantophyllas propia de plantas superiores, destinada a disipar excesos de luz y calor en lo que se denomina Non-Photochemical Quenching” (NPQ), (Extinción No Fotoquímica), operando entre el nucleo del phycobilisoma y el centro de reacción RC impidiendo que fotones de alta energía degraden el fotosistema.
El core del sistema es la “Proteina Carotenoide Naranja”, “OCP”, ver Fig 4, molécula soluble en agua con un peso molecular de 35 kDa, dos dominios, C-Terminal (CTD) y N-terminal (NTD), separados por un linker que actúa a manera de bisagra entre los dominios, una terminal N extendida (NTE) contribuyendo a mantener CTD y NTD adyacentes en estado ground (OCPO) y un cofactor keto-carotenoide (Canthaxanthina).
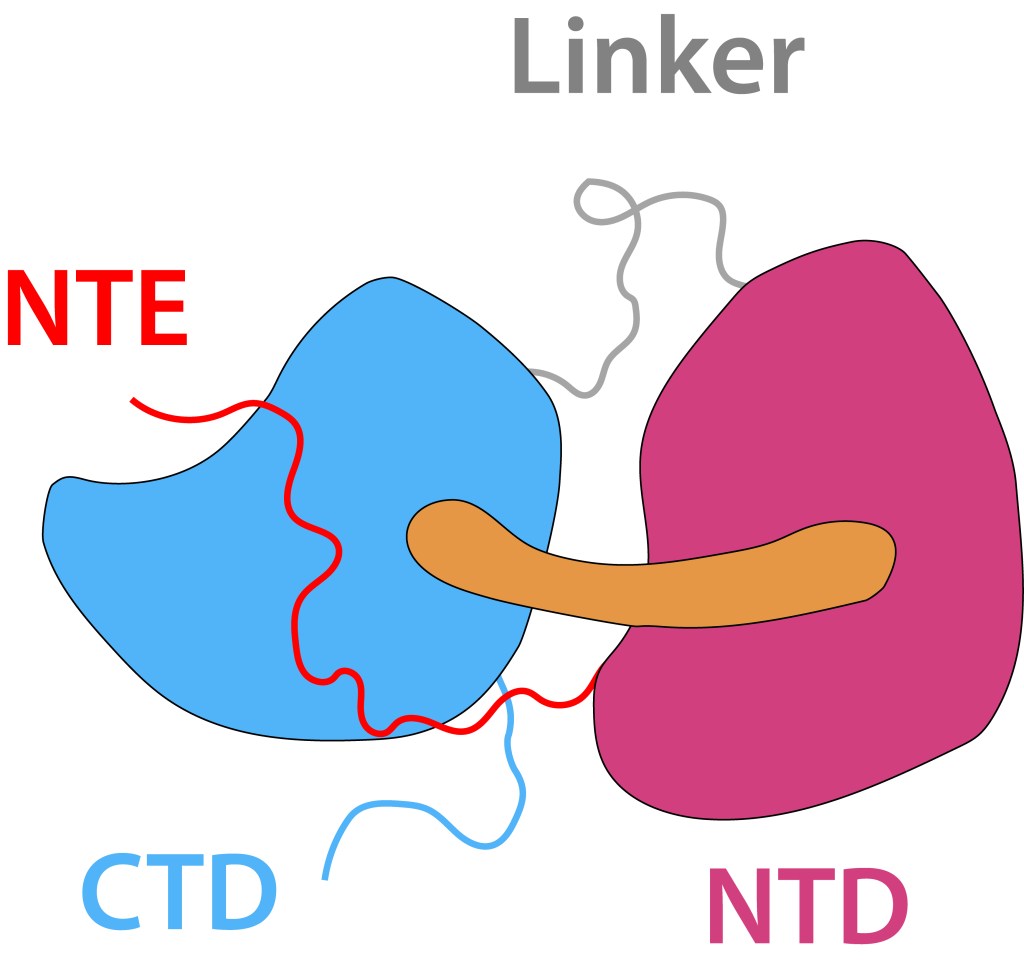
Figura 4. Orange Carotene Proteine (OCP). Elementos principales
Ante la exposición a luz de alta energía, el cofactor Caanthaxanthina sufre cambios reversibles en su estructura molecular espacial, ver Fig. 5, con alteraciones en la absorción/emisión lumínica, pasando de naranja (ground) a roja en estado activado, loque define dos estados: OCP0 → OCPR.
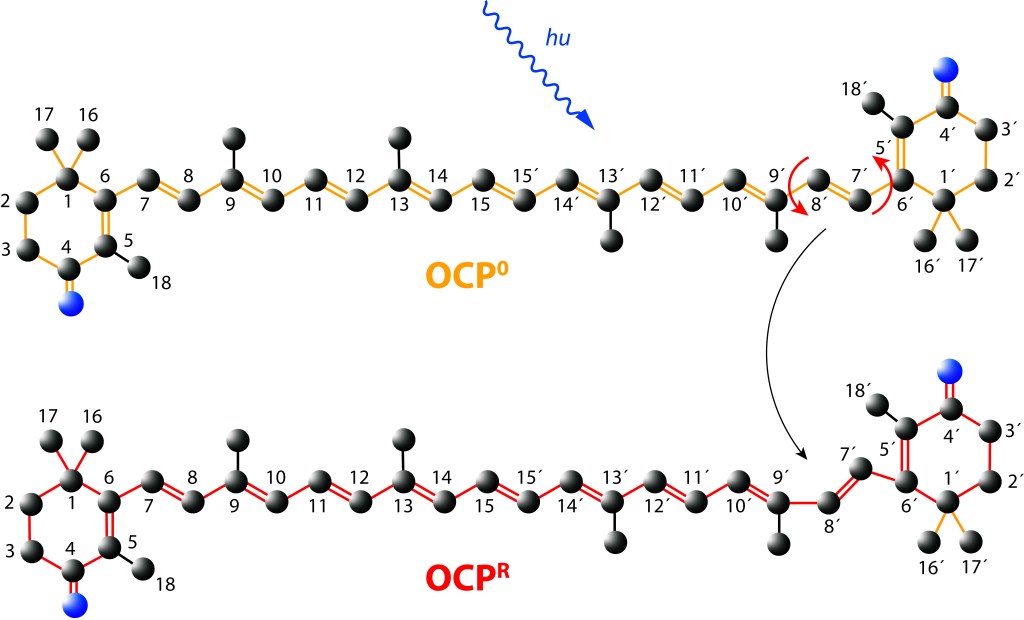
Figura 5. Canthaxantica en estado Ground (OCP0) y estado exitado (OCPR)
Estos cambios generan a su vez alteraciones reversibles en OCP, ver Fig 5., incluyendo translocación del caroteno hacia el domino NTD y separación de los dominios N-terminal y C-terminal ver Fig.6.
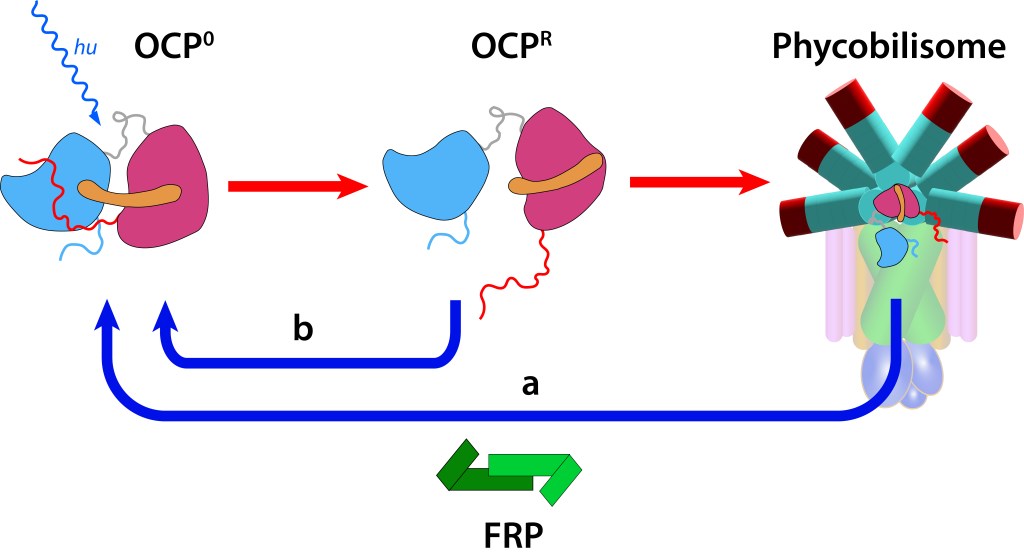
Figura 6. Estructura y función OCP. (Modificado de Maksimov et.al, 2017).
En este estado OCPR actúa a nivel del nucleo del phycobilisoma impidiendo que alta energía se transmita hacia el centro de reacción, protegiendo de esta manera al fotosistema (fotoprotección NPQ).
Si la protección del fotosistema no es requerida, la proteina retorna a estado OCP0 mediante la acción del dímero FRP (Fluorescence Recovery Protein), lo que permite la reactivación de la función fotosintética.
BIBLIOGRAFÍA
- Zolotereva, E., Polishuk,O. Chlororespiration as a Protective Stress-inducible Electron Transport Pathway in Chloroplasts. The Open Agriculture Journal • 14 Oct 2022
- Slonimskiy, Y.B., Maksimov, E.G. & Sluchanko, N.N. Fluorescence recovery protein: a powerful yet underexplored regulator of photoprotection in cyanobacteria†. Photochem Photobiol Sci 19, 763–775 (2020). https://doi.org/10.1039/d0pp00015a
- Maksimov EG, Sluchanko NN, Slonimskiy YB, Mironov KS, Klementiev KE, Moldenhauer M, Friedrich T, Los DA, Paschenko VZ, Rubin AB. The Unique Protein-to-Protein Carotenoid Transfer Mechanism. Biophys J. 2017 Jul 25;113(2):402-414. doi: 10.1016/j.bpj.2017.06.002. PMID: 28746851; PMCID: PMC5529199.
- Pagels, F.; Vasconcelos, V.; Guedes, A.C. Carotenoids from Cyanobacteria: Biotechnological Potential and Optimization Strategies. Biomolecules 2021, 11, 735. https:// doi.org/10.3390/biom11050735
- Chukhutsina, V.U., Baxter, J.M., Fadini, A. et al. Light activation of Orange Carotenoid Protein reveals bicycle-pedal single-bond isomerization. Nat Commun 13, 6420 (2022). https://doi.org/10.1038/s41467-022-34137-4
