La presente lectura sobre cyanobacterias es el punto de convergencia de todas las lecturas previamente desarrolladas sobre el fenómeno de la fotosíntesis, pues este grupo bacteriano fué hace 2,500 millones de años punto de convergencia de evolución Marguliana, como también punto de divergencia Darwinista, lo que definió la impronta de la vida en nuestro planeta.
A las cyanobacterias se le debe la atmósfera planetaria rica en oxígeno, su color azul visible desde el espacio, las bandas rojas de hierro Fe3+ (Hematita Fe2O3) y Fe2+/Fe3+ (magnetita), huella geológica de su actividad bioquímica, como también la eucariogénesis y la evolución de las plantas y en último término de los animales pluricelulares, de manera que la especie humana no existiría si hace 2,500 millones de años no hubieran dominado, como dominaron, estas revolucionarias bacterias fotosintéticas.
Las Cyanobacterias son un grupo de bacterias Gram-negativas (Phyllum Cyanobacteriota) caracterizadas por realizar fotosíntesis oxigénica mediante un complejo bioquímico dual PSII-PSI, lo que las diferencia de los demás grupos fotosintéticos bacterianos, donde PSII o PSI están presentes, pero nunca operando a la vez, ver fig 1.
El complejo fotosintético se localiza en invaginaciones intracelulares de la membrana plasmática denominadas membranas Thylakoides, precursoras de las estructuras thylakoidales propias de los cloroplastos presentes en las células del reino vegetal.
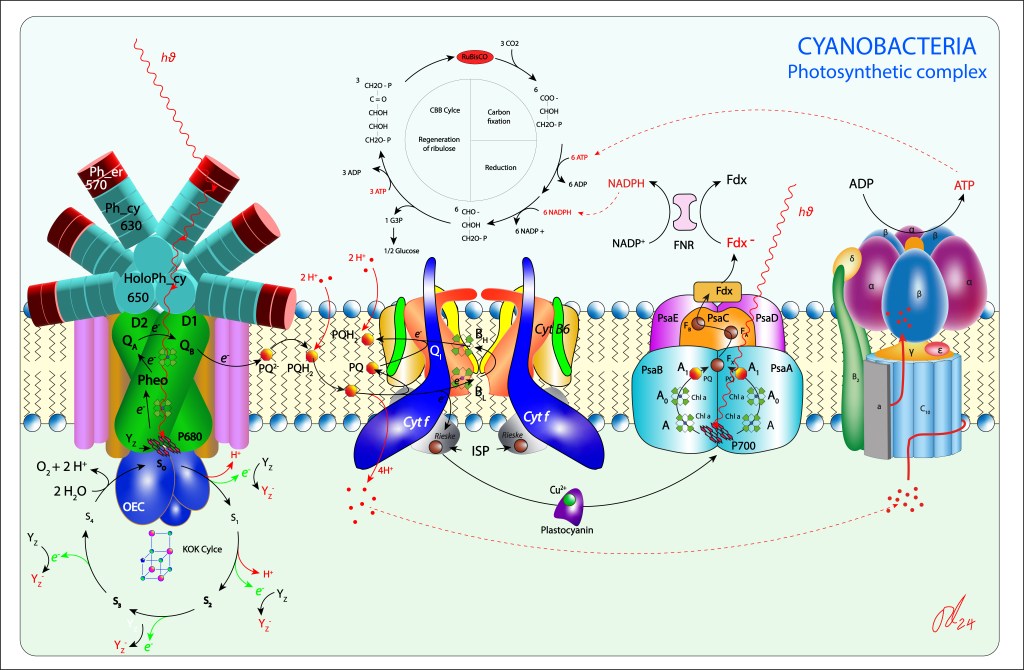
Figura 1. Complejo fotosintético de Cyanobacterias
La maquinaria fotosintétic de las cyanobacterias comprende los siguientes subsistemas:
- Complejo antena (Light Harvest Complex) denominados phycobilisomas, los cuales están intimamente ligados a los fotosistemas PSII y PSI
- Fotosistemas PSII y PSI propiamente dichos, encargados el primero de reducir quinonas y el segundo reducir NADH
- Citocromo b6f, transportador de electrones hacia PSI y responsable de la generación del potencial protónico PMF
- Centro OEC (Oxigen Evolving Center) responsable de la oxidación del agua.
- ATP Synthase, que, aunque no forma parte del complejo, es fundamental para la síntesis de ATP
A continuación un resumen general de los diferentes componentes de la maquinaria:
PHYCOBILISOMA (PBS)
Durante el proceso de la fotosíntesis, la energía lumínica es capturada por complejos antena denominados Phycobilisomas (PBS). La energía es luego transmitida hacia los centros de reacción (RC), donde pares especiales de clorofilas Chla son exitados a niveles energéticos que permiten la liberación electrónica en Chla para iniciar la cadena de transporte de electrones (ETC) , motor final de las maquinarias fotosintéticas.
Cada Phycobilisoma está compuesto por seis (raramente ocho) estructuras proteicas de corte cilíndrico en disposición radial, ver Fig 2., convergiendo hacia un nucleo proteico central.

Figura 2. Phycobilisoma. A: Vista general. Se incluye con propósito ilustrativo en tonos suaves el centro de reacción. B: Detalle estructural. C: Disposición de subunidades en los trímeros.
RADIOS:
Cada radio a su vez está conformado por 2 – 6 discos de phycobiliproteinas (10-12 nm de diámetro), los cuales actúan como unidades de captura y transferencia de energía lumínica hacia el nucleo del complejo. Los discos, de estructura trimeral, pueden operar de manera individual, trímeros (αβ)3 , o por parejas enlazadas por proteinas linker, en cuyo caso su estructura es hexameral (αβ)₆, ver Fig 2b y 2c. El rol de la proteina linker no es solamente enlazante, también contribuye a ajustar los niveles energéticos y a dirigir la energía hacia el nucleo del complejo antena.
De distal a proximal, y dependiendo de los cromóforos que contienen, las proteinas de los radios se clasifican en:
PHYCOERITHRINAS (PE) → Colectores primarios de luz .
PHYCOCYANINAS (PC) → Transfieren la energía colectada por PE hacia el nucleo del phycobilisoma.
La estructura de los radios puede variar acomodandose a la disponibilidad de energía. Así, PE puede estar ausente, en cuyo caso el colector primario es PC. De manera similar, PC puede faltar, y en ese caso PE comunica directamente con los cromóforos del nucleo.
NÚCLEO
El núcleo está conformado por 2-3 cilindros dispuestos horizontalmente, ver Fig.2a, con 6-9 discos αβ3 por cilindro, agrupados por parejas mediante proteinas linker, resultando en estructuras αβ₆.
La proteina del nucleo corresponde a ALOPHYCOCYANINA (APC), derivando su nombre del pigmento correspondiente, Alophycocyanobilina, el cual es exitado por los cromóforos radiales que actúan a modo de embudo energético. Este pigmento es el responsable de la exitación del par especial de clorofilas localizada en el centros de reaccion.
El núcleo tiene en consecuencia una función conectora entre el complejo antena y el centro de reacción RC, de manera análoga a la capa FMO de los clorosomas propios de las baterias verdes del azufre (ver lectura correspondiente), si bién presentan diferencias significativas:
- El núcleo del ficobilisoma es una estructura grande, modular y con alta plasticidad morfológica, adaptable en número de discos y organización de los mismos dependiendo de las condiciones lumínicas, mientras que FMO es un complejo pequeño,rígido en estructura, no adaptable a fluctuaciones de las condiciones ambientales.
- El cromóforo contiene Aloficocianina, conecta con el par especial Chla en RC P680 de (PSII y P700 de PSI), mientras que FMO contiene Bacterioclorofila y transmite la energía al par Bchla P840 en RC.
- El phycobilisoma requiere para su exitación de una intensidad de luz mucho mayor que el chlorosoma, lo que define y diferencia los nichos ecológicos ocupados por ambos grupos biológicos.
- El número de pigmentos presentes en el phycobilisoma es muchísimo menor que el del chlorosoma (decenas en el ficobilisoma, cientos de miles e el corosoma).
- Los pigmentos del phycobilisoma requieren proteinas estructurantes donde se anclan y organizan, mientras que la organización y distribución de pigmentos en el chlorosoma obedece a una estructura semicristalina auto-organizada, y salvo la envoltura que los contiene y la unidad conectora (FMO), hay ausencia proteínica al interior del complejo antena.
- El phycobilisoma es típico de linajes oxigénicos evolutivamente recientes, mientras que el chlorosoma es típico de fototrofía anoxigénica mucho mas antigua.
PIGMENTOS FOTOSINTÉTICOS
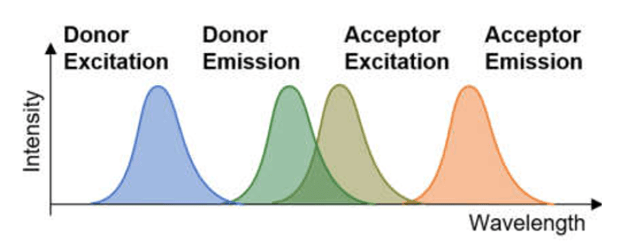
Para que la energía fluya desde el Phycobilisoma hasta PSII/PSI mediante transferencia no radiativa FRET se requiere cumplir un conjunto de condiciones:
- Energías de exitación decrementales en el sentido del flujo ETC
- Distancias reducidas entre cromóforos adyacentes
- Superposición espectral entre las frecuencias de emisión y frecuencias de exitación de pigmentos en la cadena
- Orientación favorable a FRET entre los dipolos
- Adecuada vida media de estados exitados
Las proteínas PE, PC y APC contienen los pigmentos de los tipos Phycoerytrobilina, Phycocyanobilina y Alophycocyanobilina respectivamente, cuyas energías de exitación/emisión cumplen las condiciones descritas, lo cual garantiza el flujo de energía en la secuencia
PE → PC → APC → PSII/PSI
El flujo de energía y la tabla de valores de exitación/emisión en el phycobilisoma se ilustran en la Fig 3.

Figura 3. Flujo de energía y valores de absorción/emisión correspondientes a las etapas de flujo de energía en el phycobilisoma
Los pigmentos fotosintéticos obedecen a una estructura tetrapirrólica de anillo abierto, con diferencias en el radical asociado al carbono 18 (Vinil para Phycoerytrobilina, Ethil para Phicocyanobilina y Alophycocyanobilina), y con diferencias en las posiciones de algunos enlaces Pi conjugados entre Phycocyanobilina y Alophycocyanobilina , ver Fig.4.
Estas diferencias moleculares, combinadas con las cargas eléctricas de los aminoácidos que las rodean, definen las energías de absorción/ emisión para cada tipo de pigmento.
Para los tres casos, los pigmentos están anclados a las proteínas vía residuos Cisteína mediante enlaces covalentes Tioéter.


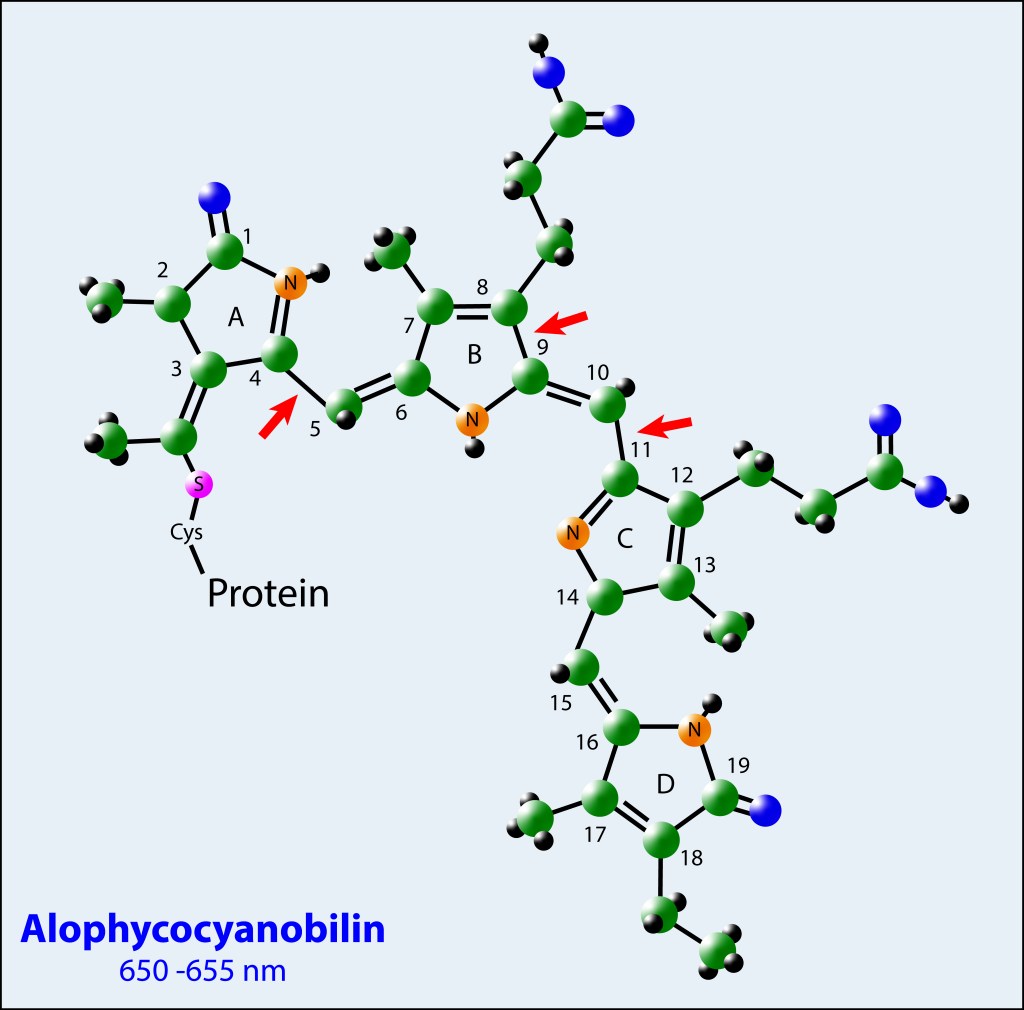
Figura 4. Estructura molecular de los pigmentos involucrados en el phycobilisoma
FOTOSISTEMA PSII
La energía capturada y transmitida desde los pigmentos de las radios hasta el nucleo del complejo es transmitida al par especial de clorofilas localizado en la base del fotosistema PSII, el cual es un complejo de proteínas transmembrana en un arreglo heterodimérico D2-D1, ver Fig.5.
El acoplamiento entre los pigmentos del nucleo y el par especial de clorofilas es mucho mas fuerte y mucho más coherente que el acoplamiento entre pigmentos al interior del phycobilisoma, lo que lo define como un caso extremo de resonancia de Förster, renombrado recientemente como EET (Exitation Energy Transfer)

Figura 5. Fotosistema PSII. Estructura y cadena de transporte ETC.
Mediante EET, la energía procedente del complejo antena exita el par especial de clorofilas P680 llevandolo a su forma P680*, elevando su potencial redox de
+ 1,2 → -0,9 eV
Si los requerimientos energéticos celulares son bajos, el par especial retorna al estado Ground mediante fluorescencia, ver Fig 6.
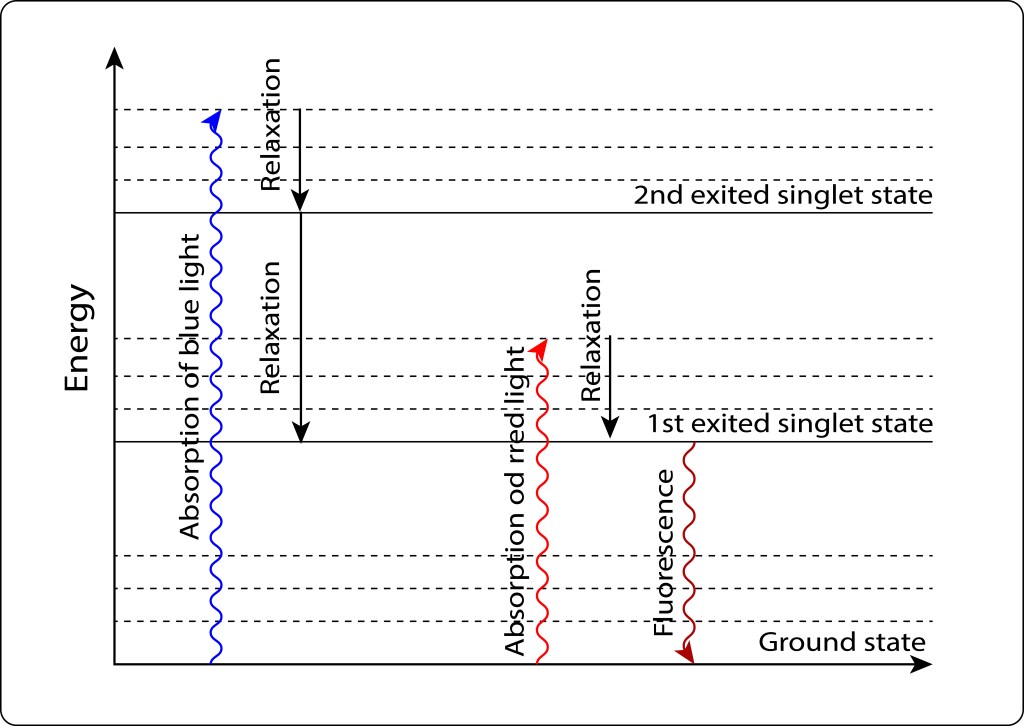
Figura 6. Exitación/relajación electrónica en pigmentos fotosintéticos
Ante demanda energética, el electrón exitado π* (procedente de la cadena de enlaces conjugados), no retorna a ground sino que se libera oxidando el par especial de clorofilas Chla , iniciando una cadena de transporte de electrones ETC, que en su primera fase (PSII) sigue la ruta ETC
P680* → Pheophytin → Quinone A → Quinonne B → Plastoquinol
El pigmento Phaeophitin corresponde estructuralmente a una molécula de clorofila Chla sin presencia del átomo central de magnesio coordinado. Las quinonas corresponden a Plastoquinonas, muy estables en ambientes ricos en oxígeno.
Para reducirse completamente, las plastoquinonas PQA y PQB requieren dos electrones, de manera que el ciclo de exitación y liberación electrónica del par especial de clorofilas debe repetirse dos veces, y previamente dos fotones deben ser capturados y transmitidos a RC secuencialmente por parte del complejo antena.
Una vez completamente reducida, PQB2- captura dos protones procedentes del citoplasma adquiriendo la forma de Plastoquinol PQH2 :
PQB → PQB∙− → PQB2- → PQH2
Mientras que PQA está ligada fuértemente a PSII, PQB es fácilmente liberada en su forma plasoquinol, migrando a un reservorio especial de quinonas localizado en el espacio intramembrana thylakoidal denominado pool de quinonas, ver Fig 7.
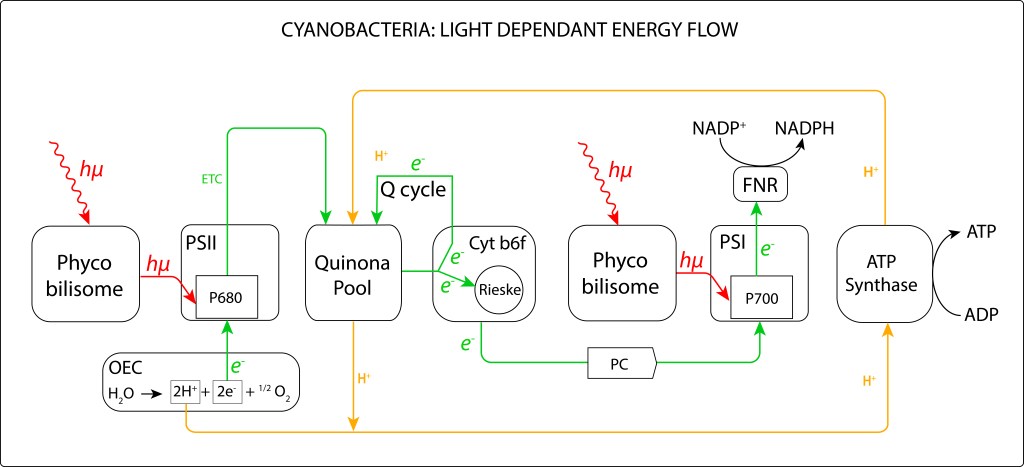
Figura 7. Diagrama de flujo de energía en el complejo fotosintético de Cyanobacterias, reacciones dependientes de luz.
Para que la cadena de transporte ETC siga una dirección “cuesta abajo” desde P680* hasta PQH2 en PSII, (y más adelante hacia el pool de quinonas y finalmente hasta P700 en PSI), los “eslabones” de la cadena de transporte deben estar acoplados de modo que sus potenciales redox vayan disminuyendo paso a paso, ver Fig.8.
El tránsito de electrones a lo largo del proceso, al igual que en los complejos fotosintéticos presentes en los demás grupos bacterianos y en la maquinaria de foforilación oxidativa mitocondrial, permite generar un gradiente protónico intermembrana (PMF) indispensable para la síntesis de ATP.
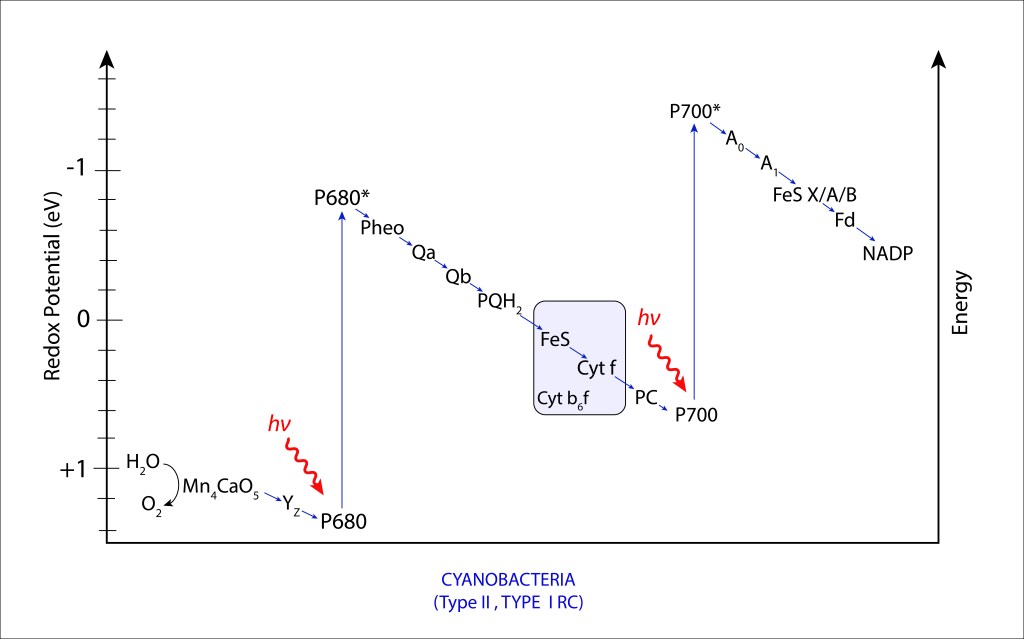
Figura 8. Diagrama Z en el complejo fotosintético PSII/PSI de Cyanobacterias.
El transito de electrones descrito en la fig. 8 se conoce como ESQUEMA Z, que en resumen describe la forma en “Z” del transporte no cíclico de electrones durante las reacciones dependientes de la luz en la fotosíntesis de cyanobacterias y plantas superiores.
El Esquema “Z” comprende dos fases, correspondientes a PSII y PSI respectivameente. PSI maneja niveles energéticos mayores que PSII, lo que define para PSII un alto poder oxidante y para PSI un alto poder reductor, convirtiendo al sistema combinado en una maquinaria altamente oxidante, altamente reductora, que en la práctica se traduce en capacidad de oxidar H2O y capacidad de reducir NADP+ de manera directa. Comparativamente, maquinarias de un solo fotosistema, como las presentes en bacterias púrpura y bacterias verdes del azufre, la eficiencia fotosintética general está limitada. En las primeras, el débil poder reductor impide la síntesis directa de NADPH, teniento que invertir valioso ATP en su producción, mientras que en bacterias verdes del azufre ocurre lo contrario. Se habilita la síntesis directa de NADPH pero el bajo poder oxidante impide la utilización de H2O como fuente de electrones, ver Fig 9.

Figura 9. Centros de reacción de Bacterias púrpura y verdes del azufre
Hace algo cercano a 2,500 millones de años, sea por endosimbiosis seriada entre linajes de bacterias con maquinarias complementarias tipo I y tipo II, sea por adquisición de un segundo fotosistema por evolución propia , o sea por transferencia genética horizontal entre linajes, en lo que podría ser una especie de endosimbiosis bioquímica, de alguna manera dos maquinarias fotosintéticas se combinaron resultando en una máquina dotada de un “carburador de doble venturi” capaz de oxidar el agua, lo que marcó un punto de no retorno en la vida del planeta.
La utilización de agua como fuente de electrones en éste novedoso proceso fotosintético ha sido de lejos la más importante y trascendental innovación evolutiva alcanzada en el planeta. El nuevo recurso eliminó la dependencia de electrones procedentes de fuentes de limitado acceso (H2S, moléculas orgánicas, etc) permitiendo que las cyanobacterias pudieran ocupar todos los rincones del planeta donde hubiera agua líquida, convirtiendose así en el grupo más exitoso y de lejos más dominante que haya existido hasta la fecha .
Pero esta dominancia tuvo su lado obscuro, pués también fué la responsable de alterar profundamente la atmósfera primigenia, rica en dióxido de carbono y metano, por una atmósfera de oxígeno, lo que amenazó seriamente las formas de vida anoxigénica que prosperaban en ese entonces .
POOL DE QUINONAS
Como se mencionó anteriormente, el pool de quinonas es un depósito de quinonas oxidadas y reducidas ubicada en el espacio intramembrana tylakoidal, adyacente a los complejos fotosintéticos PSII, PSI y al Cyt b6f.
La naturaleza hidrofóbica de las quinonas permite que éstas permanezcan confinadas en dicho espacio, repelidas por los radicales fosfato de la capa bifosfolipídica.
La proporción y concentraciones de las formas PQ / PQH2 es dinámica y depende de los requerimientos fisiológicos, siendo PQH2 la portadora de energía desde PSII hacia en citocromo b6f.
CITOCROMO b6f
El complejo Cyt b6f es un complejo proteínico transmembrana con moléculas Heme como cofactores, ver Fig 10. Sus funciones consisten en transferir electrones al fotosistema PSI orientados a síntesis de NADPH y mover protones del citoplasma al lumen thylakoide mediante una secuencia de oxidaciones y reducciones de quinonas aprovechando una cadena de transporte de electrones ETC habilitada por cambios reversibles entre los estados de oxidación Fe³⁺ / Fe²⁺ de átomos de hierro presentes en moléculas Heme al interior del complejo.
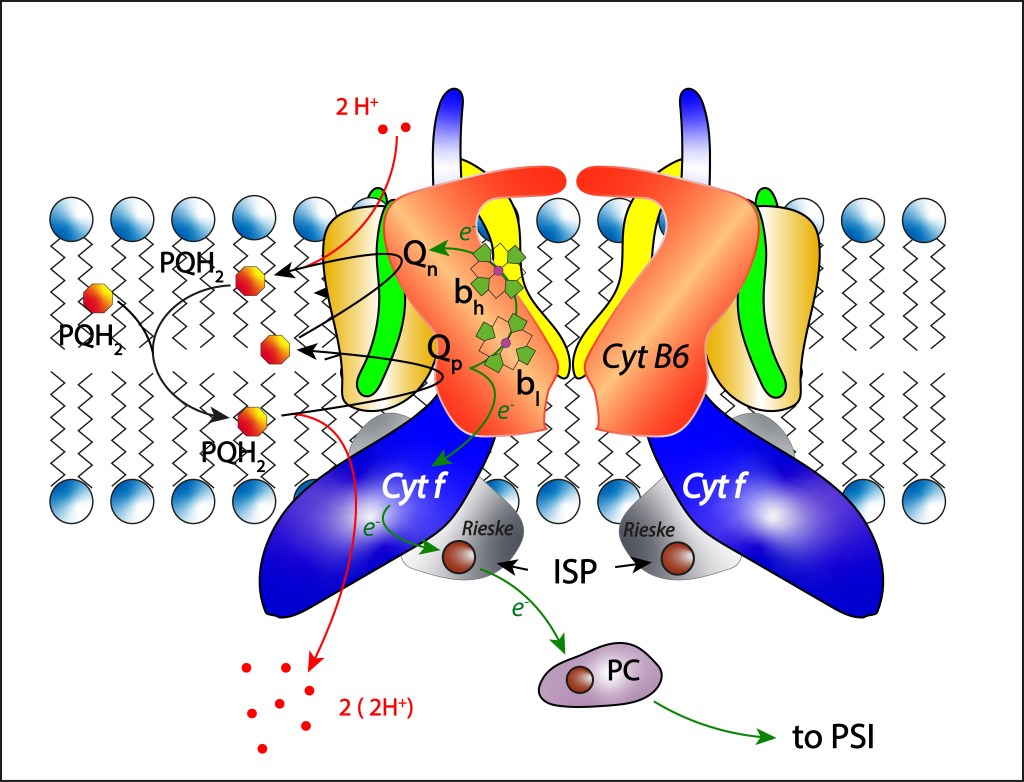
Fig 10. Estructura del citocromo Cytb6f, y dinámica de transporte de electrones ETC.
La subunidad Cyt B6 tiene dos sitios activos, Qp oxidante y Qn reductor, responsables de alojar las quinonas a oxidar y reducir, respectivamente.
Del pool de quinonas es transladada una molécula PQH2 a Qp donde es oxidada a su forma PQ. Dos protones y dos electrones son liberados en la reacción. Los protones migran al lumen htilakoide donde contribuyen a incrementar la fuerza protomotriz PMF que luego se utilizará pra la síntesis de ATP.
En cuanto a los electrones, tienen dos destinos diferentes:
El primer electrón es capturado por el complejo 2Fe2S, cofactor de la proteína Rieske (Iron Sulfur Protein ISP) quien a su vez reduce una cuproproteina móvil presentee e el lúmen thylakoide denominada Plastocianina, responsable final de la transferencia de electrones desde Cyt b6f hasta PSI siguiendo la ruta
Qp → Cytf → [2Fe2S] → PC → P700–
En cuanto a Rieske, el centro [2Fe2S] está coordinado por dos histidinas y dos cisteínas, en lugar de las cuatro Cystinas que caracterizan a la ferredoxina [2Fe2S], ver Fig 11.
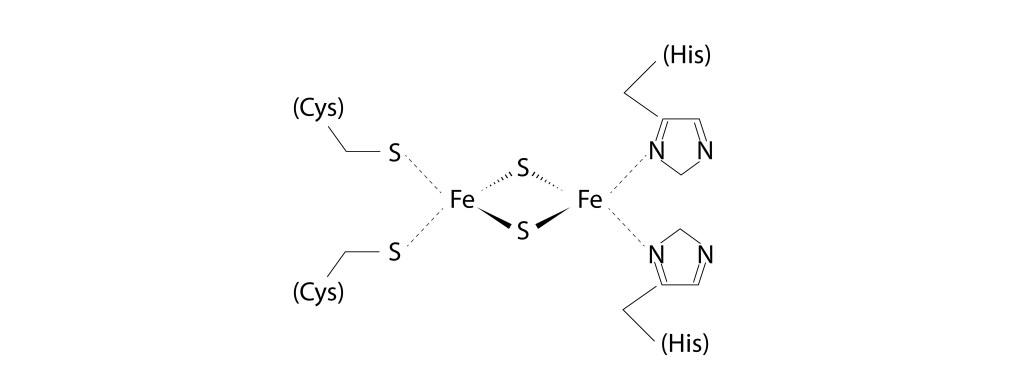
Fig 11. Centro [2Fe-2S] presente en la proteina Rieske
Respecto a la Plastocianina (PC), se trata de una proteína móvil transportadora de electrones con un átomo de cobre como cofactor anclado a la proteina mediante cuatro ligandos: Imidazol de dos residuos histidina (His37, His87) , thiolato de Cys84 y thioether de Met92, lo que le confiere una estructura de tetrahedro irregular. Durante el proceso el cobre es reducido de la forma
Cu²⁺ → Cu⁺
En estado reducido, PC migra en el lumen hasta el PSI, donde dona el electrón a P700⁺, volviendo a su forma oxidada Cu²⁺.
Respecto al segundo electrón, este sigue la ruta
bl → bh (o bl → cn) → PQ
mediante cambios en los estados de oxidación Fe3+ – Fe2+ de los Heme correspondientes, para finalmente reducir parcialmente una plastoquinona PQ localizada en el sitio Qn .
Son necesarios dos ciclos como el descrito arriba para reducir completamnte la plastoquiuinona PQ localizada en Qn.
Una vez totalmente reducida, la plastoquinona incorpora dos protones procedentes del citoplasma a su estructura, retornando luego al pool de quinonas en su forma PQH2 .
Completados los dos ciclos, cuatro protones son transladados del citoplasma al lumen tylakoidal.
FOTOSISTEMA PSI
El fotosistema PSI es el último complejo involucrado en la cadena de transporte de electrones, su función es reducir NADP+ a partir de la oxidación del átomo de cobre precente en PC, por lo cual se conoce atmbién como Plastocianina-NADP Oxidoreductasa., ver Fig 12.
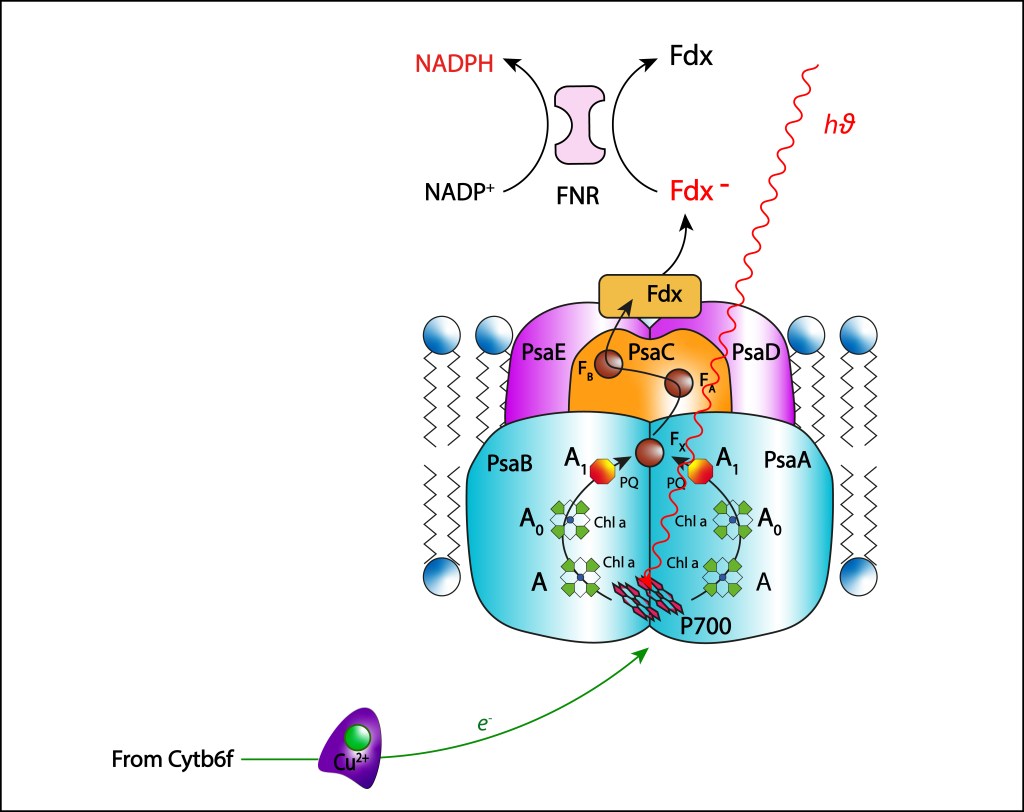
Figura 12. Fotosistema PSI. Estructura y cadena de transporte ETC
Como en el caso de PSII, complejos antena tipo phycobilisomas son responsables de transferir la energíalumínica al par especial de clorofilas, en este caso al dímero P700, con la energía necesaria para que un electrón sea liberado del par especial iniciando la cadena de transporte correspondiente.
Una vez liberado el electrón, el par especial adquiere el potencial oxidante necesario para oxidar la plastocianina PC procedente del complejo Rieske, retornando el par especial a su estado Ground, cambiando el estado de oxidación del átomo de cobre:
Cu⁺ → Cu2⁺
Dos ramas simétricas de cofactores están presentes en PSI. Las ramas parten de P700 al interior de las subunidades PSaB y PSaA, cada una conteniendo una molécula accessoria de Chla ( A), una segunda monomérica Chla ( A0) y una filoquinona (A1). Las dos ramas convergen en un cluster [4Fe-4S] central (Fx), ver Fig 13, apuntando hacia el citoplasma.
A pesar de existir dos ramas paralelas de cofactores A-Ao-A1, solo una es responsable de la cadena de transporte de electrones, usualmente la rama localizada en PSaA, mientras que la segunda rama, presente en PSaB , permanece inactiva.
De Fx la energía es transferida hacia dos cluster [4Fe-4S] denominados FA y FB localizados en la subunidad proteínica PsaC, para finalmente reducir una ferredoxina 2Fe-2S Fe-S , denominada Fdx, localizada en el citoplasma.
La ferredoxina requere dos electrones para reducirse completamente, de modo que dos ciclos secuenciales PC-Ferredoxina deben ser completados.
Éste agente reductor no transfiere directamente electrones a NADP+ , requiriendo una enzima intermediaria denominada ferredoxina-NADP+ reductasa (FNR). La transferencia de electrones se realiza en dos pasos:
FNR → Flavin-Semiquinona → FADH2
Una vez completamente reducida, FNR transfiere los dos electrones a NADP+ .
En resumen, la cadena de transporte ETC en PSI sigue los siguientes pasos:
P700∗ → A → A0 → A1 → Fx → FA → FB → Fdx → FNR – NADPH
OXIGEN EVOLVING CENTER OEC
Con la síntesis de NADPH y la habilitación de síntesis de ATP mediante la generación de fuerza protomotríz PMF por el sistema parecería que el tema quedaría cubierto.
Sin embargo queda pendiente el tema de reposición de electrones en PSII para que la maquinaria fotosintética pueda operar ininterrumpídamente.
La oxidación de P680 inicializa el fljo ETC mediante la cesión electrónica, pero a su vez, gracias al alto poder oxidante adquirido, permite reincorporarlos desde la fuente primaria, H2O, mediante una innovacion evolutiva, El ciclo de Joliot-Kok mediado por Mn4CaO5 , ciclo que opera en un complejo proteínico denominado Oxigen Evolving Center, “OEC”.
Como core del complejo OEC y como centro oxidante se presenta una molécula de estructura cubana, ver Fig 13, y fórmula molecular Mn4CaO5, responsable final de la oxidación del agua.

Figura 13. Diagrama 3D de la molécula Mn4CaO5. Se incluyen en la molécula las cuatro moléculas coordinadas de agua
El tránsito de electrones desde MnCaO5 hacia el par de clorofilas es mediado por un residuo Tyr 161 (Yz), en la secuencia
H2O → Mn4CaO5 → Yz → P680*
Al ceder electrones, P680* adquiere un potencial oxidativo muy alto (~+1,25v) , lo que permite oxidar Tyr161 quien a su vez oxida MnCaO5 para que tras un ciclo repetido pueda oxidar el agua , ver Fig.14.

Figura 14. Ciclo de KOK. Las cuatro barras en cada estado representan los cuatro átomos de manganeso, barras azules indican átomos en estado de oxidación III, barras rojas estado IV.
Como etapa previa al ciclo de KOK, la energía de un fotón procedente del complejo antena promueve la liberación de un electrón en P680, lo que lo lleva a un estado P680* altamente oxidativo. Este potencial es transladado al centro OEC con el propósito final de oxidación del H2O.
El elemento responsable de los estados de potencial corresponde a los cuatro átomos de Mn, que pueden tener los siguientes estados de oxidación:
Mn neutro: [Ar] 3d⁵ 4s²
Mn(III): [Ar] 3d⁴ (Paramagnético, 4 electrones despareados)
Mn(IV): [Ar] 3d³
Las etapas del ciclo de KOK se pueden resumir así:
- S0 → S1: Partiendo de un estado inicial en Mn4CaO5 con Mn1 – Mn3 en estado de oxidación III y Mn4 en estado de oxidación IV, P680* promueve la oxidación de Tyr161 y luego la oxidación de Mn3 en Mn4CaO5 (con la consecuente reposición electrónica en P680), lo que genera en el core de OEC un potencial de +0,8v.
- S1 →S2: Segundo fotón incidente, segundo electrón liberado, se eleva el potencial oxidativo del core a de +0,8v a 0,9v , oxidación de Mn2 pasando del estado MnIII a MnIV, liberación de H+ al lumen thylakoide.
- S2 →S3: Tercer fotón incidente, tercer electrón liberado, captura de una primera molécula de agua, liberación de H+ al lumen thylakoide, el core adquiere un potencial de ~+1,0 – +1,1, oxidación de Mn1 pasando del estado MnIII a MnIV.
- S3 →S4 → S0: Cuarto fotón incidente y cuarto electrón liberado. Con todos los átomos de Mn en estado de oxidación +IV, el potencial de oxidación general es lo suficientememnte alto como para generar un enlace O-O a partir de H2O, de manera que sus electrones se puedan incorporan al sistema, retornando de paso los estados de oxidación de los átomos de Mn a sus condiciones iniciales para así poderse iniciar un nuevo ciclo.
S2 y S3 son estados metaestables, particularmente en ausencia o deficiencia de luz, pudiendo decaer el sistema a S0, lo que hace que el poder oxidante acumulado se pierda.
La secuencia presentada se basa en un modelo de oxidación de “valencia alta” (High valence), caracterizada por átomos de Mn en estados de oxidación III y IV.
Este modelo presupone en la etapa S4, previa la formación del enlace O-O, la oxidación de un átomo de Mn a un estado V, estado energéticamente extremo, difícil de explicar bajo el modelo de Lewis y en conflicto con algunos datos espectroscópicos experimentales.
Una segunda alternativa se basa en un modelo de bajo potencial (Low potential), en el que no es necesario recurrir a estados de oxidación extremos y donde la energía adicional es resuelta mediante Radicales Oxyl (O.), Puentes Oxo deprotonados y Oxidación centrada en ligandos, y no en los átomos de Mn.
Bajo este modelo, el manganeso Mn1 participa en S0 con un estado de oxidación II , y en general, a lo largo de todo el ciclo, los estados de oxidación del core son menores que los del modelo de potencial alto, ver Fig 15.

Este modelo explica de mejor manera el ciclo, no es necesario recurrir a estados energéticos extremos, pero por otro lado el hecho de manejar menores potenciales de oxidación abre interrogantes sobre la capacidad de oxidación del agua.
Para concluir, la sinergia bioquímica resultante de combinar los fotosistemas PSII y PSI en una única maquinaria fotosintética fuertemente oxidante y a la vez fuertemente reductora, sumado al desarrollo de un novedoso complejo bioquímico diseñado para extraer electrones del agua, permitió que toda una nueva propuesta bioquímica, la de las formas de vida aerobia, conquistara el planeta en una explosión evolutiva que aún hoy, después de 2,500 millones de años, nos acompaña.
Lidiar con el oxígeno, sin embargo, no ha sido tarea fácil para la vida, e incluso la maquinaria fotosintética que lo liberó por primera vez debe lidiar con él.
Los mecanismos de protección ROS, y en general las rutas de control diseñadas para proteger la maquinaria fotosintética, serán el tema de la próxima lectura.



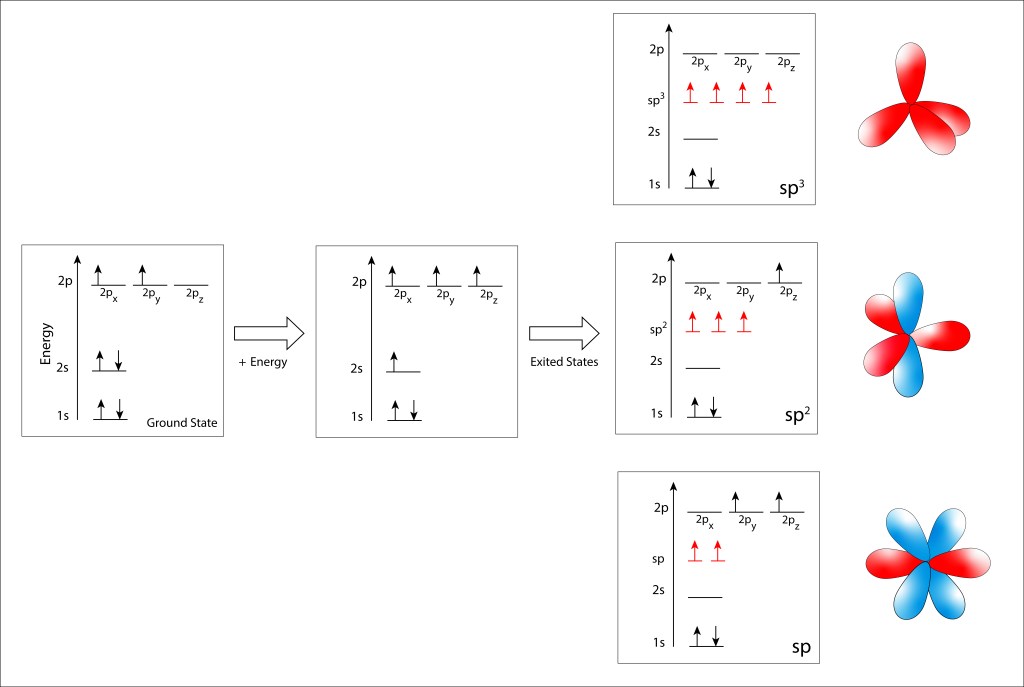
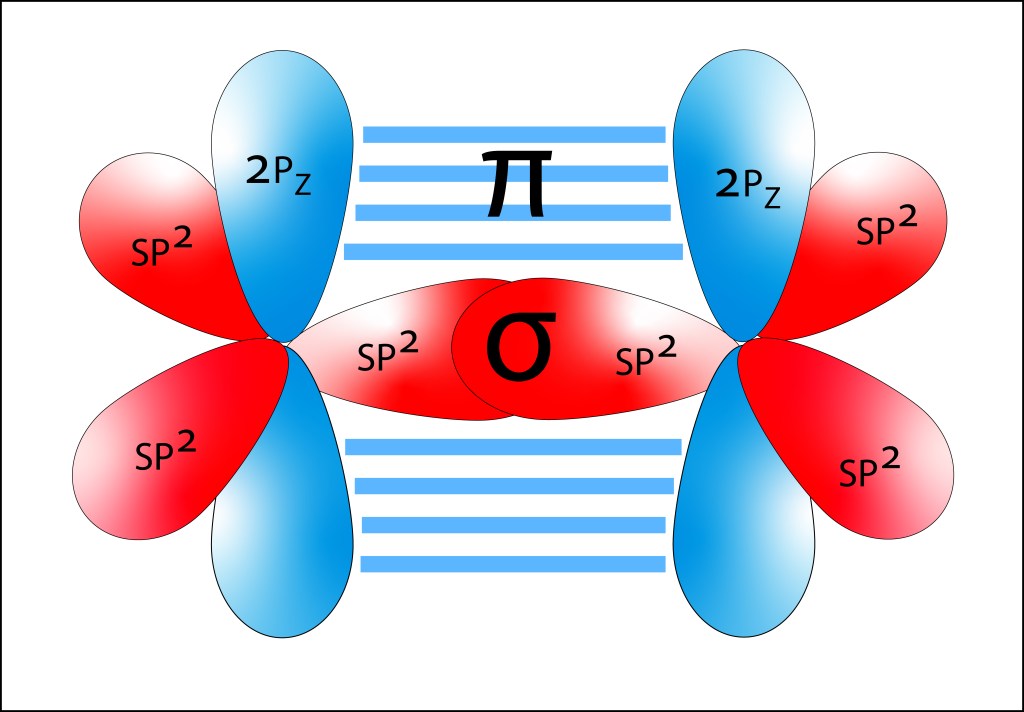
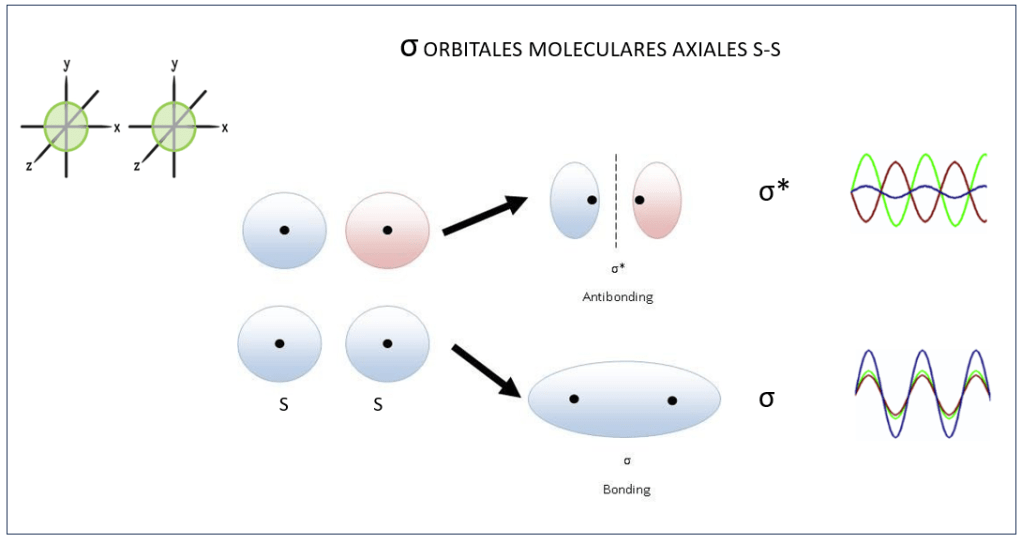




 , corresponden a los siguientes eigenspinors:
, corresponden a los siguientes eigenspinors: