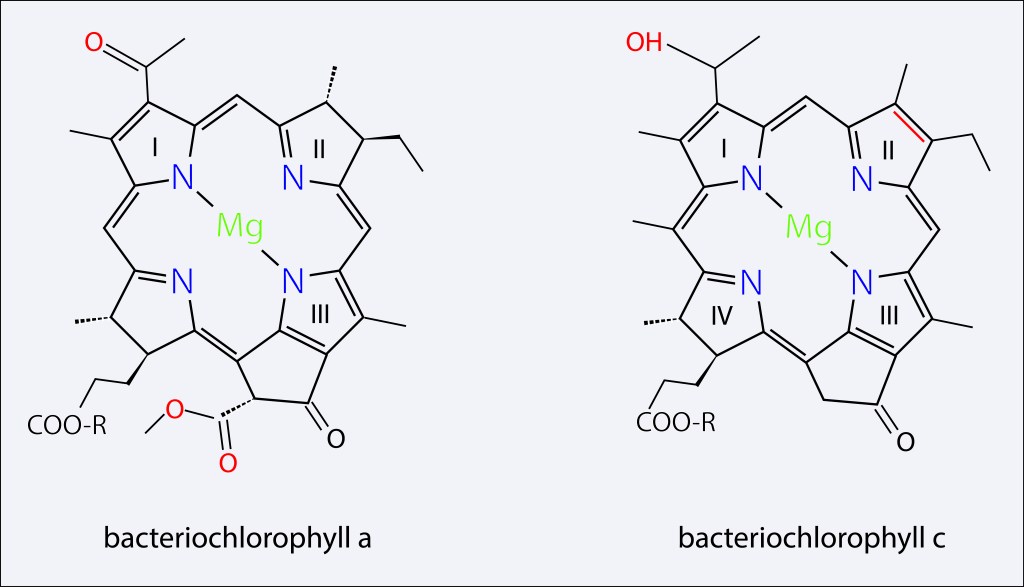
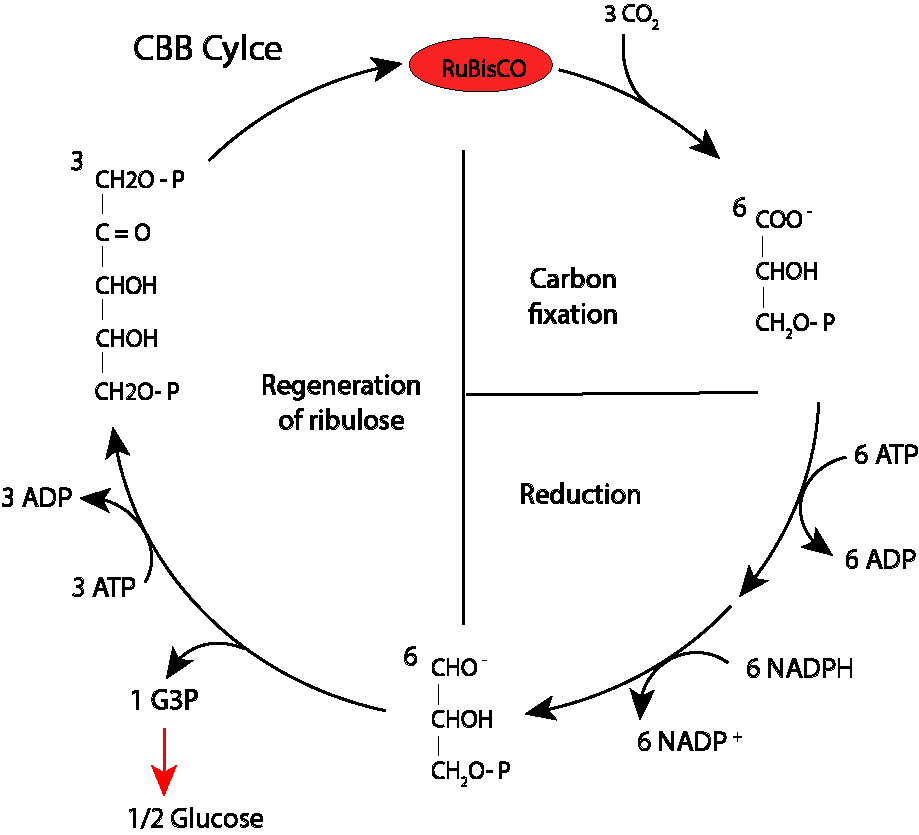
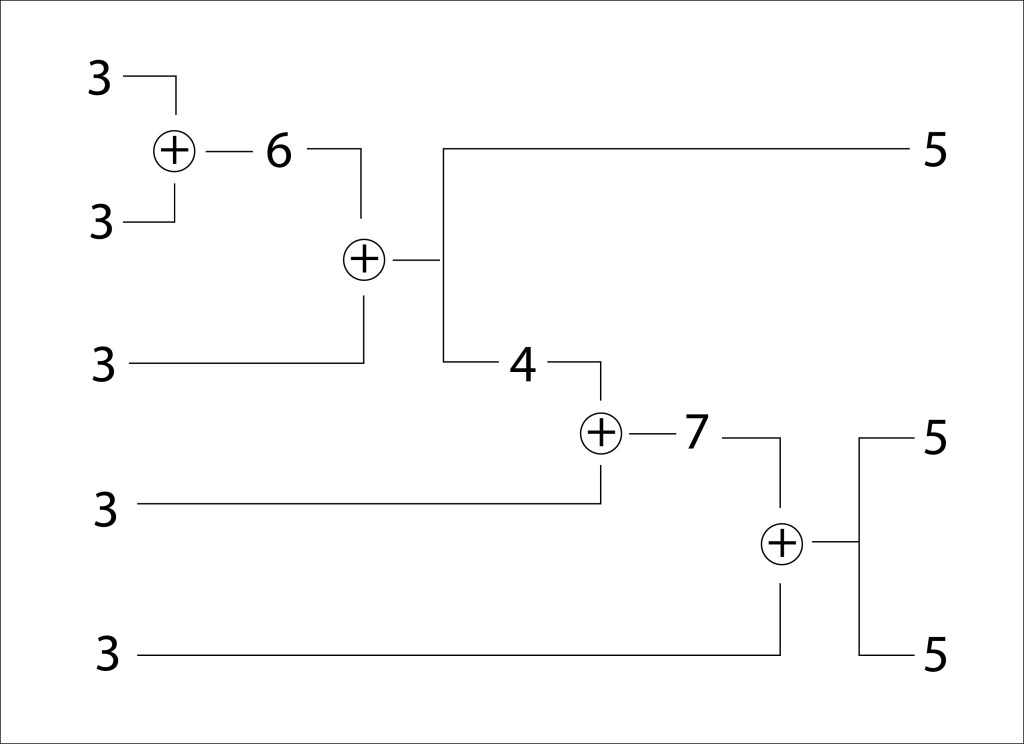
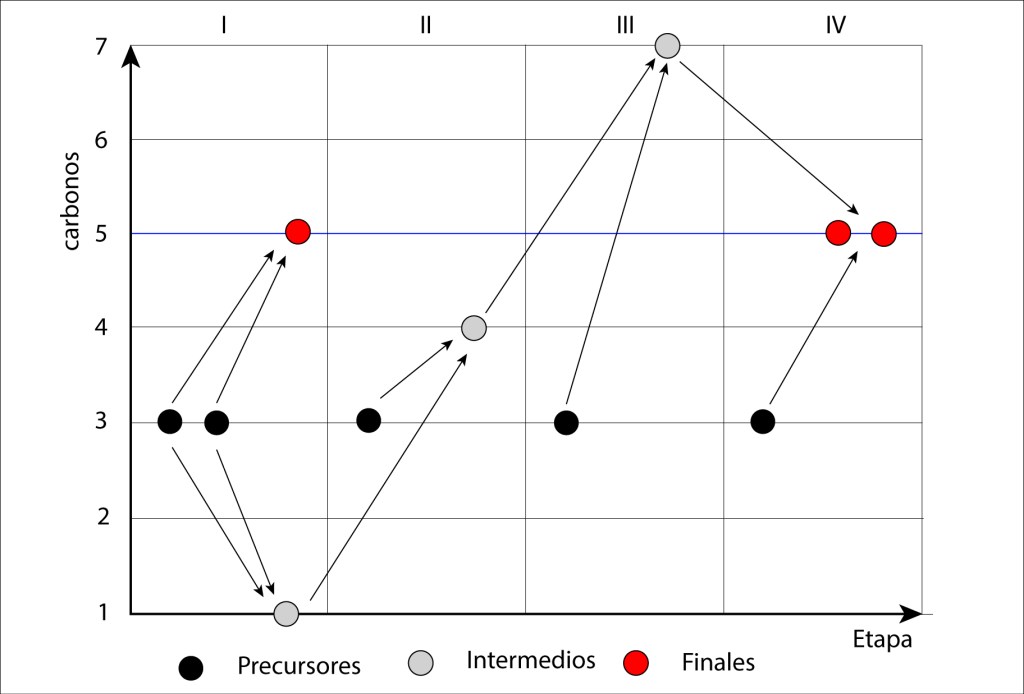
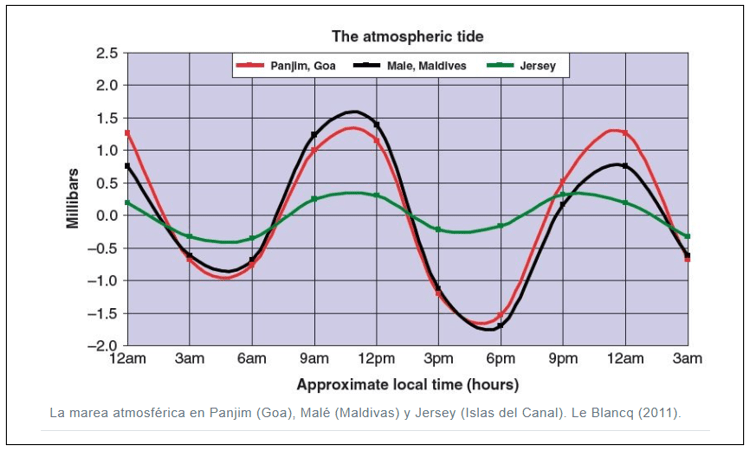
Aunque está suficientemente documentado el ciclo de vida de las Angiospermas, no es fácil encontrar diagramas lo suficientemente claros y autocontenidos, de manera que incluyo uno que espero cumpla las condiciones mencionadas.
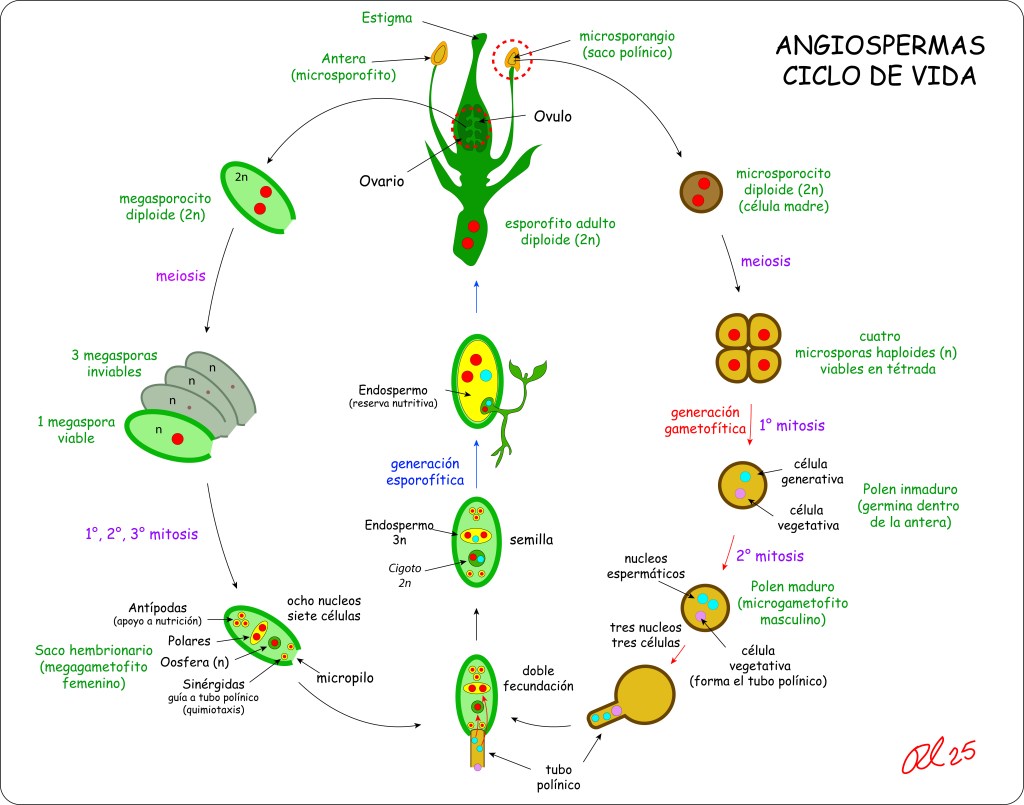
Como se puede apreciar en la figura, en las angiospermas el grano de polen o microgametofito se compone de solo dos células con sus correspondientes nucleos espermáticos, lo que contrasta con las gimnospermas, en las cuales el microgametofito desarrolla cuatro células: Dos células protálicas vestigiales, resultado de la evolución a partir de antepasados con gametofitos masculinos más complejos, mas una célula generativa y una célula formadora del tubo polínico, estas dos últimas procedentes de la división mitótica de la célula anteridial.
Retornando a las angiospermas, mientras un nucleo fecunda el óvulo, dando lugar a un embrión diploide, el segundo nucleo fecunda la célula polar binucleada para generar el endospermo triploide 3N.
La doble fertilización, la simplificación del grano de polen a solo dos células, y la generacción de un endospermo triploide son considerados los principales diferenciadores entre Angiospermas y Gimnospermas.
La estrategia de contar con un endospermo 3N tiene varias implicaciones :
- MAYOR RESERVA NUTRICIONAL: Contar con una dosis extra de genes se traduce en una mayor capacidad biosintética de recursos nutricionales.
- BALANCE GENÓMICO DIFERENCIAL MADRE/PADRE: Puesto que 2/3 del genoma del endospermo provienen de la madre (nucleos polares), hay un mayor control materno sobre el uso de los recursos nutricionales consumidos por el embrión. (ver “Teoría del Conflicto Parental” más adelante).
- OPTIMIZACIÓN DE RECURSOS: La doble fecundación garantiza que el endospermo solo se forme si hay fecundación previa del óvulo, de modo que no se desperdicien recursos formando tejido nutritivo innecesario (ahorro en energía y en recursos).
- EFICIENCIA Y SINCRONIZACIÓN: Contar con un endospermo que pueda desarrollarse de manera independiente al desarrollo del embrión permite que la disponibilidad de recursos nutricionales se ajuste a los requerimientos nutricionales del embrión.
TEORÍA DEL CONFLICTO PARENTAL
La “Teoría del Conflicto Parental” , o “Teoría del Conflicto genómico“, fué propuesta por David Haig y Mark Westoby en 1989 tratando de explicar los justificantes de un endospermo triploide con alelos madre/padre diferenciales 2:1.
Como idea central, la teoría expone que existe un “conflicto de intereses” entre los genes de la madre y los del padre respecto a los recursos requeridos para el desarrollo de los embriones.
Desde el punto de vista de los intereses maternos, y puesto que las semillas pueden provenir de distintos padres, distribuir equitativamente los recursos asegura la supervivencia del mayor número de progenie. Al fín y al cabo, todas las semillas portan sus genes.
El control materno limita en buena medida los intereses paternos, que consisten en asegurar la mayor cantidad de recursos para su descendencia, a costa de recursos para la demás progenie.
Otras dos teorías han sido propuestas para explicar el diferencial genómico.A continuación se presentan de manera simplificada, pues exceden los propósitos de la presente lectura:
TEORÍA DE COADAPTACIÓN MATERNO-FILIAL
Propuesta por Wolf y Hager, 2006, Wolf y Hager, 2009; Wolf, 2013, aplicable no solo a plantas, resalta la idea de coadaptación (más que conflicto entre intereses genéticos madre-hijo, ver teoría de Haig, 1990´s) , lo que resulta en coevolución y sincronía adaptativa de mutuo beneficio madre-embrión.
TEORÍA DEL ANTAGONISMO SEXUAL
Day y Bonduriansky, 2004; Bonduriansky, 2007.
De acuerdo a la teoría, existen genes que afectan de manera diferencial el éxito reproductivo de machos y hembras, conduciendo a que una misma variante genética puede beneficiar a un sexo y perjudicar al otro.
Esto genera un antagonismo sexual y una tensión evolutiva entre las adaptaciones masculinas y femeninas.
BIBLIOGRAFIA RECOMENDADA
Day T, Bonduriansky R. Intralocus sexual conflict can drive the evolution of genomic imprinting. 2004. Genetics 167: 1537–1546.
Haig D, Westoby M. Parent-Specific Gene Expression and the Triploid Endosperm. Am. Nat. 1989. Vol. 134. pp. 147-155.
Wolf J, Hager R. A Maternal–Offspring Coadaptation Theory for the Evolution of Genomic Imprinting. PLoS Biology. 2006. Vol 4 Issue 12 e380







 , corresponden a los siguientes eigenspinors:
, corresponden a los siguientes eigenspinors: