Las bacterias púrpura son un grupo de proteobacterias Gram negativas pertenecientes al órden Chromatiales, clase Gammaproteobacterias, presentes en cuerpos de agua anóxicos con alta iluminación.
A nivel bioquímico es un grupo muy versátil, pues dependiendo de las condiciones y recursos energéticos disponibles puede activar rutas de metabolismo fotoautótrofo, fotoheterótrofo, fermentativo, o respiratorio (anaerobio o aerobio).
Dada la importancia ecológica del grupo (particularmente como agente purificador de aguas residuales), su bioquímica ha sido ampliamente estudiada. La comprensión de su función fotosintética es de gran ayuda para abordar la dinámica de maquinarias más complejas, particularmente las correspondientes a cyanobacterias, algas y plantas superiores.
Antes de describir en detalle dicha maquinaria, vale la pena revisar algunos conceptos generales del fenómeno.
La fotosíntesis se define como el proceso de captura de energía lumínica y transpormación a energíia química, utilizando CO2 como fuente de carbono, estando presente en varios grupos bacterianos de bacterias, en algas y en plantas superiores.
El proceso comprende dos fases:
- REACCIONES DEPENDIENTES DE LA LUZ: Ejecutadas de manera secuencial por diferentes complejos proteínicos transmembrana, parten de la captura de energía lumínica y se extienden hasta la síntesis de ATP y NADPH, ver Fig.1.

Fig.1. Etapas de las reacciones dependientes de la luz en la fotosíntesis.
- REACCIONES NO DEPENDIENTES DE LUZ: Corresponde a un conjunto de reacciones de biosíntesis partiendo de agua y CO2, utilizando ATP y NADPH como fuentes e energía. Esta fase se realiza en el citoplasma mediante diversas rutas metabólicas reductoras, que dependiendo del grupo biológico pueden corresponder al ciclo de Calvin-Benson-Bassham (ciclo de las pentosas fosfato reductoras) , al ciclo reverso del ácido tricarboxílico o a la ruta del hidroxi-propionato, principalmente.
REACCIONES DEPENDIENTES DE LA LUZ
En las bacterias púrpura, las reacciones fotosintéticas dependientes de la luz ocurren en organelos especializados de la membrana interna celular, denominadas cromóforos o cromatóforos, ver Fig 2.

Fig 2. Cromatóforo en Rhodobacter sphaeroides. Fuente: Sener MK et al, 2007. Atomic level structure and function of an entire biological membrane: the photosynthetic unit of Rhodobacter sphaeroides. Proc Natl Acad Sci USA 104
Los cromatóforos surgen de invaginaciones de la membrana citoplasmática interna. Cada invaginación genera un volumen periplasmático confinado, limitado hacia el exterior por la membrana externa, ver Fig.3.
El reducido volumen de periplasma al interior del cromatóforo optimiza la generación de un gradiente de carga positiva, PMF, esencial para la síntesis de ATP.
Estrategias de confinamiento equivalentes se presentan en los Tilakoides de los cloroplastos, las invaginaciones tilakoidales de cyanobacterias, en el espacio periplasmático de heliobacterias e incluso en las crestas mitocondriales propias de células eukariotas.

Fig 3. Estructura de un cromatóforo
Las reacciones dependientes de la luz comprenden las siguientes etapas:
- CAPTURA DE LUZ
- EXITACIÓN DEL PAR ESPECIAL DE CLOROFILAS PRESENTES EN EL CENTRO DE REACCIÓN RC TIPO II (P870)
- FLUJO DE ELECTRONES (Electron Transport Chain, ETC) a lo largo de una sucesión de reacciones de oxidoreducción a partir de la exitación y oxidación del par especial de clorofilas.
- FUERZA PROTOMOTRIZ PMF (generación de un potencial protónico)
- SÍNTESIS DE ATP (a partir de PMF como energía generatriz).
La Fig.4. resume a manera de diagrama de flujo el proceso fotosintético en este grupo, resaltando el colores los diferentes tiposde energía, incluyendo en rojo la energía lumínica (correspondiente a la captura y transporte de fotones), en verde la energía eléctrica, cuyo flujo se denomina ETC (Electron Transport Chain), en amarillo el flujo protónico (o flujo de iones H+) y finalmente en negro la depositación final de energía en la forma de ATP. Se omite en el diagrama la síntesis de NADPH, tema que se abordará más adelante, el cual requiere ATP y enzimas reductoras específicas. Con fines ilustrativos el centro de reacción RC y el complejo II se tratan como bloques independientes, si bién corresponden a un solo heterodimérico con sumbunidades L, M.

Fig 4. Diagrama de flujo reacciones fotosintéticas depenientes de la luz en bacterias púrpura
Como se aprecia en la figura, el complejo fotosintético de este grupo bacteriano se caracteriza por tener un solo fotosistema (Tipo II) , el cual es responsable de la reducción de quinonas y depositación de las mismas en el pool de quinonas, y un citocromo BC1 que activado por las quinonas reducidas responde por la generación de fuerza protomotríz (PMF) requerida para la síntesis de ATP y de la retroalimentación de electrones de vuelta al sistema. Finalmente, las reacciones dependientes de la luz, como también todas las maquinarias respiratorias, cierran el proceso mediante la enzima ATP Synthase, la cual es responsable de la síntesis de ATP, lo que permite en último término que la energía lumínica se transforme en energía química, se exprese en complejidad bioquímica y sostenga el proceso global celular operando adecuadamente .
Una vez acumulada la energía en forma de ATP entran en juego las reacciones no dependientes de la luz, anteriormente llamadas reacciones de obscuridad, que en este caso están representadas por el ciclo CBB. Este ciclo, activado por las moléculas mencionadas, permite capturar carbono a partir de CO2 y sintetizar glucosa. El ciclo se tratará de forma detallada en otra lectura. La fIG.5 exponede manera detallada la maquinaria fotosintética de bacterias púrpura . En la esquina superior izquierda de la figura se ilustra la invaginacion de la membrana interna y el espacio periplasmático donde tiene lugar el proceso.

Fig 5. Bacterias púrpura: Aparato fotosintético
REACCIONES DEPENDIENTES DE LA LUZ
- CAPTURA DE LUZ (LIGHT HARVESTING)
En bacterias púrpura, la energía lumínica exita pigmentos fotosintéticos, carotenos y clorofilas, geométricamente distribuídos al interior de dos tipos de complejos proteicos transmembrana denominados complejos antena LHII y LHI, ver Fig 6.
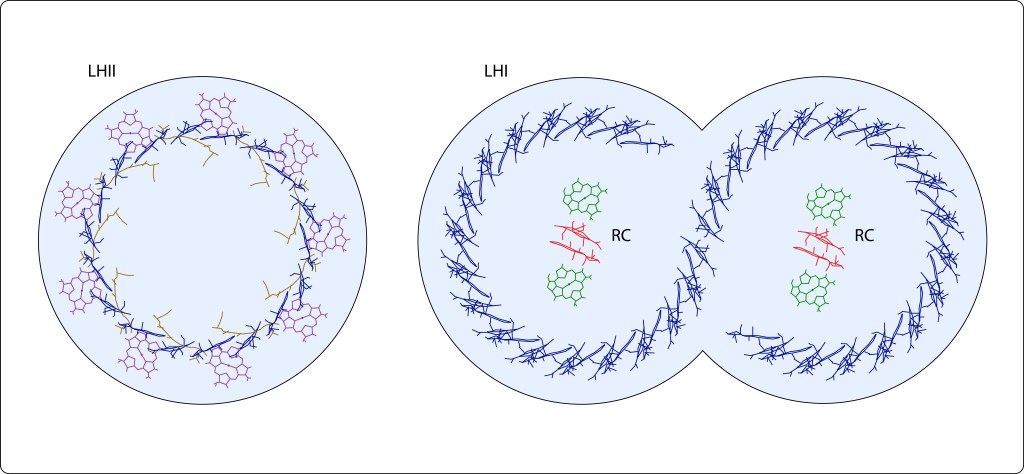
Fig 6. Vista superior de los complejos antena de Bacterias Púrpura. LHII (izquierda) contiene 9 carotenos (café) en empalizada , 9 Bchla´s paralelas y 18 Bchl´s perpendiculares a la membrana plasmática. LHI dimérico en forma de “S” contiene 36X2 clorofilas dispuestas perpendicularmente a la membrana plasmática. Círculos en azul claro representan las proteinas transmembrana correspondientes a cada monomero.
Mediante resonancia no radiativa (Resonancia de Förster) y coherencia cuántica, la energía capturada en LHII es transferida a LHI, para finalmente ser transladada a un par especial de bacterioclorofilas, denominadas Special Pair, localizadas en el Centro de Reacción, RC, ver Fig 7.
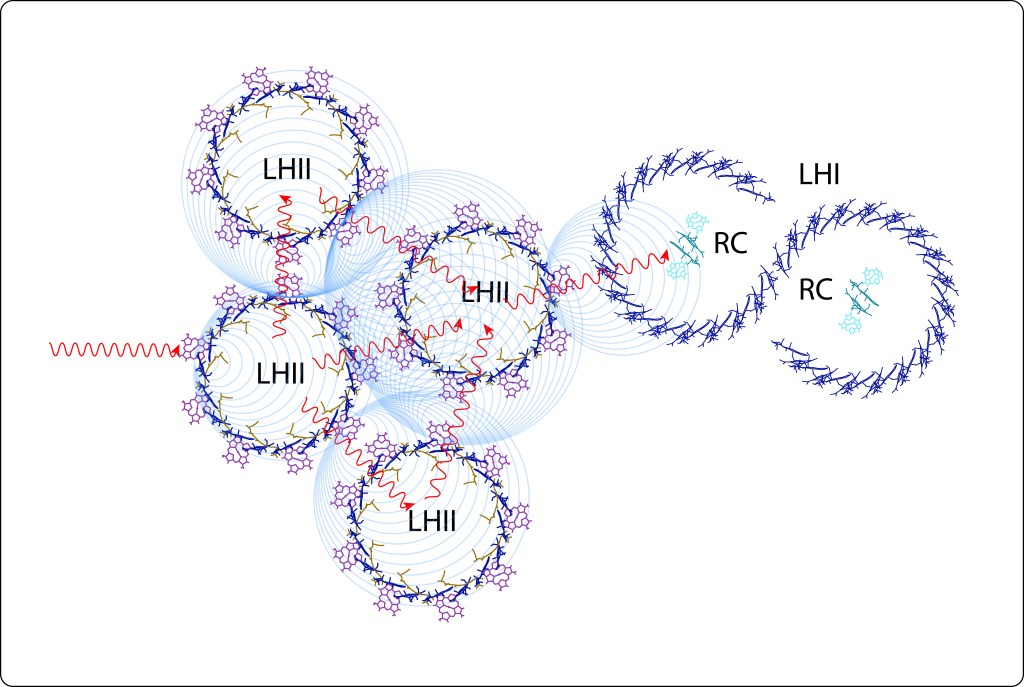
Fig 7. Flujo de energía desde los Complejos Antena LH hasta en centro de reacción RC.
La transferencia radiativa implica una disminución gradual de la energía en el tránsito desde LHII hasta LHI.
2. EXITACIÓN DEL PAR ESPECIAL DE CLOROFILAS
El par especial P870 en RC exitado por un valor de energía superior al valor de exitación de su donor en LHI (B875)., ver Fig. 8, lo cual se debe probablemente al efecto combinado de coherencia y superradiancia cuánticas.

Fig 8. Energías y rutas de exitación en los Complejos Antena LH hasta en centro de reacción RC. Transcrito de Proc. Natl. Acad. Sci. USA 95 (1998)
3. FLUJO DE ELECTRONES ETC
El flujo de energía lumínica, indicado con flechas en rojo en la Fig 8., tiene lugar vía LHII → LHI → P870 en RC, mientras que la cadena de transporte de electrones ETC, flechas en verde, ocurre desde el par especial hasta PQ b en el centro de reacción RC. Ver Fig.9.
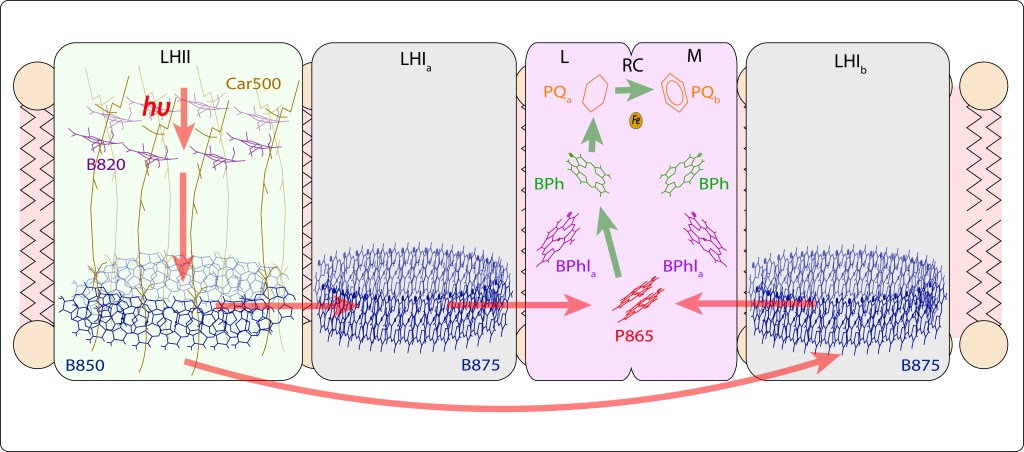
Fig 9. Flujo de energía en los complejos antena de Bacterias Púrpura. Se incluye la transferencia de LHI a RC, y la cadena de transporte en RC, tema amplado más adelante. Las subunidades LHIa y LHIb en la imagen corresponden a un único complejo LHI en “S” , ver también Fig 3., rodeando el centro de reacción RC . Note que el complejo proteico de RC está formado por un dímeero con subunidades L, M.
NIVELES DE ENERGÍA
Los pigmentos fortosintéticos presentan, dependiendo de la energía incidente, dos niveles de exitación: 1° y 2° estados en singlete, ver Fig 10.

Fig 10. Niveles de energía en la molécula de clorofila. Dependiendo de la luz incidente, el estado de exitación puede ser 2° singlete (banda azul), o 1° singlete (banda roja). Fuente : Biochemistry & Molecular Biology of Plants.2015, John Willey & Sons.
Electrones en 2° singlete se relajan rápidamente de manera expontánea a 1° singlete por conversión interna (IC) y liberación de calor, mientras que los de 1° singlete (en el caso del par especial de clorofilas) pueden tener dos destinos:
- Retorno a GND por fluorescencia
- Liberación desde el par especial vía REDOX (reducción de BPha como primer aceptor de electrones) , iniciandose con este evento la cadena de transporte de electrones ETC. La ruta tomada dependerá de los requerimientos fisiológicos de ATP. Alta demanda favorecerá ETC, caso contrario la molécula retornará a GND.
Ante demanda de ATP, el electrón cedido por el par especial inicia una serie de reacciones REDOX en cadena, ver Fig 10.
P865 → BPha → QA → QB.
Cofatores adicionales, BChla y Fe2+ , indicados en la figura 11., no participan directamente en la cadena de transporte, su función es estabilizar la carga local para facilitar la unidireccionalidad de la cadena de reacciones.
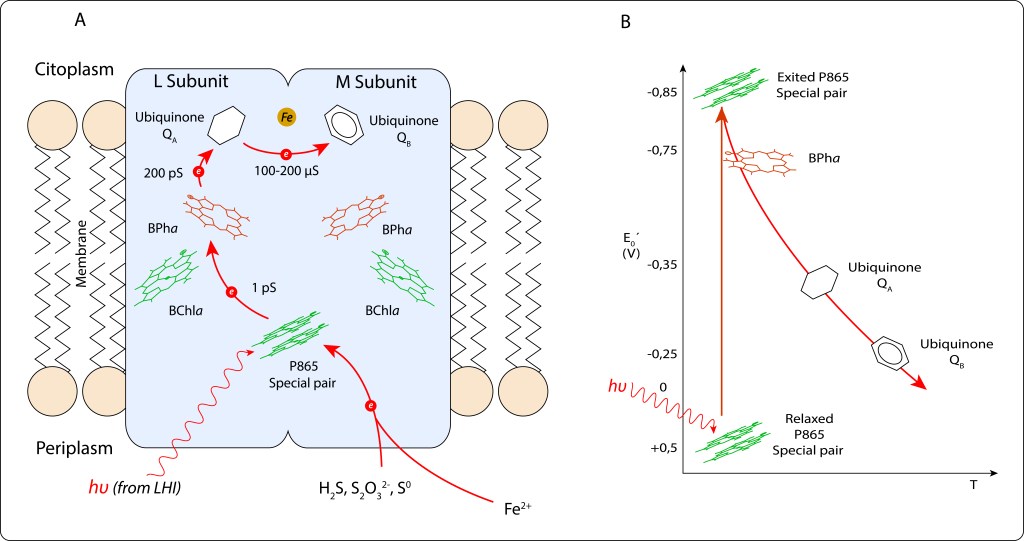
Fig 11. Cadena de transporte de electrones en RC. A. Pigmentos y moléculas involucradas en el transporte. B. Niveles de energía correspondientes a cada etapa.
El aceptor final en RC, Q b , requiere dos electrones para reducirse completamente, ver Fig 12., de modo que el par especial debe ceder secuencialmente dos electrones , lo que implica captura de dos fotones por parte de los complejos antena y consecuentemente utilización de los dos electrones que proceden del citocromo C en una ruta cíclica.
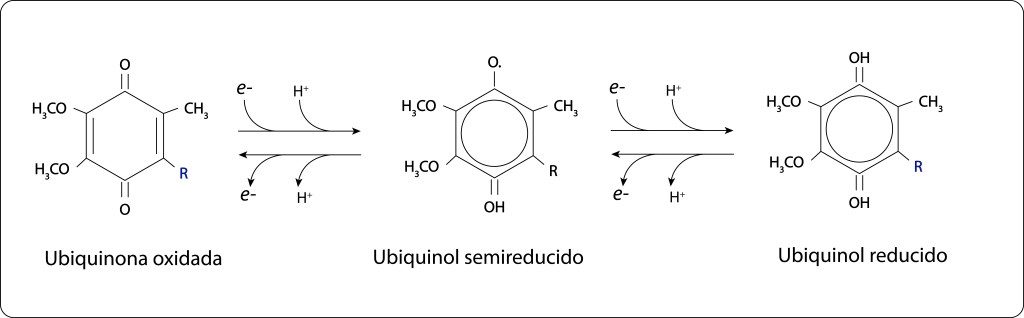
Fig 12. Reducción de Ubiquinona a Ubiquinol, pasando por Ubiquinol semireducido.
La plastoquinona completamente reducida migra al pool de quinonas y mediante la adquisición de 2 cationes H+ procedentes del citoplasma se convierte rapidamente en Plastoquinol . El confinamiento de plastoquinonas y plastoquinol al interior de la membrana citoplasmática interna es posible gracias a su alta hidrofobicidad molecular, de manera que los fosfatos de la bicapa fosfolipídica actuan como barrera de retención manteniendo las quinonas y quinoles en el pool a disposición del citocromo Bc1.
4. FUERZA PROTOMOTRIZ PMF
Ubiquinol se convierte entonces en el portador de energía a ser utilizado por el citocromo bc1 para la generación del gradiente protónico requerido para la síntesis posterior de ATP.
El complejo citocromo bc1 , al igual que b6f en cianobaterias y en mitocondrias de células eucariotas, se caracteriza por contener moléculas Heme como cofactores responsables del transporte de electrones.
En bc1, tres Heme participan en el transporte de electrones, dos en Cyt b y una en Cyt c1; lo que contrasta con el centro de reacción RC, donde los cofactores responsables del transporte corresponden a clorofilas, phaeophytinas y quinonas.
En Heme, un átomo de Hierro Fe2+ es quelatado de manera similar a la quelatación de magnesio Mg2+ en las clorofilas y bacterioclorofilas, ver Fig 13.

Fig 13. Esquema comparativo de las moléculas de Bacterioclorofila a y Heme.
Mientras que en RC los electrones cedidos por el par especial de clorofilas corresponden a electrones π de la cadena resonante de enlaces conjugados, en heme los electrones provienen del ión ferroso Fe2+ al pasar a estado férrico Fe3+.
Heme y clorofila comparten una misma ruta de síntesis metabólica, partiendo del ácido δ-aminolevulínico (ALA) hasta el subproducto protoporfirina IX. De ahí en adelante los agentes quelatantes y demás diferenciadores definen el producto final.
El Ubiquinol (QH2) exportado desde el centro de reacción al pool de quinonas es redireccionado al sitio Qp del CytB, ver Fig 14, donde es totalmente oxidado.
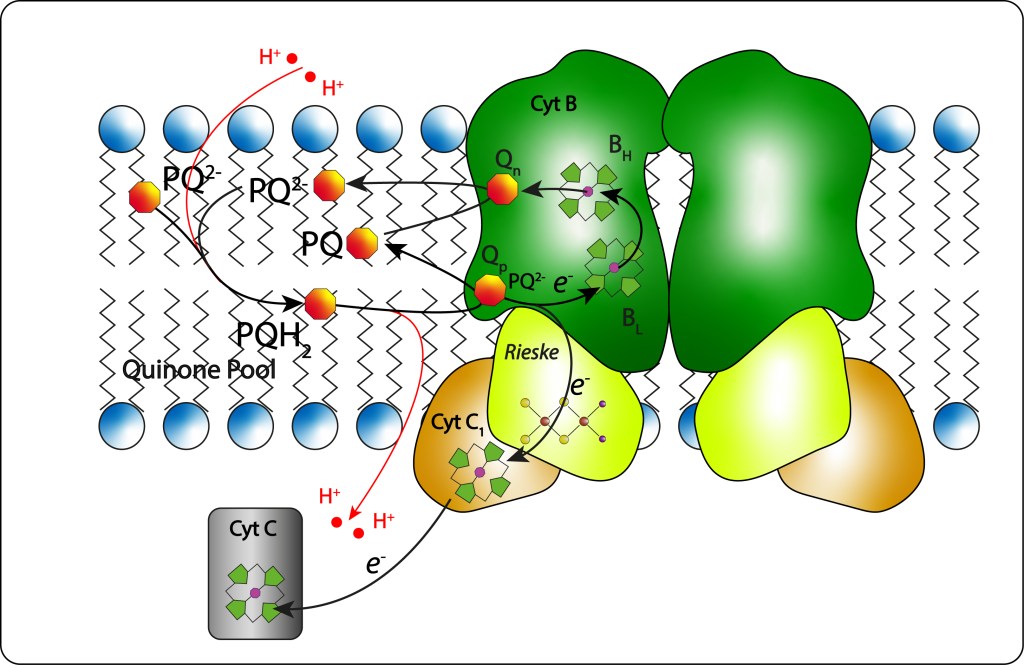
Fig 14. Cytochrome BC1. Función y diagrama general
Un primer electrón es capturado por el cofactor Fe2S2 del complejo Rieske, ver Fig 15., de allí pasa al citocromo C1 y luego al Cyt C2 soluble que lo lleva de nuevo al centro de reacción RC para reducir el par especial de clorofilas, pudiendo reiniciarse así un nuevo ciclo de transporte de electrones.

Fig 15. Complejo Rieske. Uno de los dos hierros es coordinado por dos residuos His definiendo su alto potencial Redox.
El segundo electron sigue una ruta diferente: Heme Bl (bajo potencial) -> Heme BH (alto potencial) → quinona Q (localizada en un segundo sitio de CitB: Qn) reduciendola parcialmente (Q → Q–) , de manera que la reducción completa de Q implica la reducción de dos ubiquinoles.
La figura 16 ilustra los potenciales Redox en bacterias púrpura y bacterias verdes del azufre (para fines comparativos) a lo largo de la cadena de transporte de electrones, incluyendo las etapas que tienen lugar en RC y las etapas en Cyt bc1. Note que en bacterias púrpura la reducción de NAD+ de manera directa por la vía de fotosíntesis, por su alto valor de potencial.
Como se puede observar, de manera global los potenciales Redox de bacterias púrpura son menores comparados con los potenciales de bacterias verdes del azufre.
Esto define para el sistema de bacterias púrpura un poder oxidante fuerte, reductor débil, mientras que GSB se define un poder oidante débil, reductor fuerte.
la importancia de esta diferencia en poder oxidoreductor entre uno y otro grupo biológico se entenderá más adelante, al abordar las cyanobacterias, un grupo biológico que por endosimbiosis bioquímica (término personal propuesto en estas lecturas) integró los dos fotosistemas en una sola maquinaria fuertemente oxidante, fuertemente reductora, capaz de oxidar H2O y capaz de reducir NAD+ de manera autónoma, lo que en su momento evolutivo defino un nuevo curso para la vida en el planeta.

Figura 16. Potenciales redox en bacterias purpura y verdes del azufre
5. SÍNTESIS DE ATP
Como resultado de la oxidación del Ubiquinol, dos hidrogeniones H+ son exportados al periplasma contribuyendo a generar el gradiente PMF requerido para la síntesis de ATP.
El citocromo BC1 actua entonces como una bomba de protones, desde el citoplasma al periplasma, y el PMF generado actúa como habilitante de la ATP Synthase, último complejo de la cadena de reacciónes dependientes de la luz.
El diferencial de iones H+ entre periplasma y citoplasma, PFM, es utilizado por ATP synthase para la síntesis de ATP.
Si el Citocromo BC1 es una bomba de protones, ATP synthase es una verdadera ensambladora rotativa de tres tiempos, admisión, compresión y expulsión, con un rotor dotado de tres sitios activos separados 120° entre sí. La rotación es habilitada gracias al flujo de protones procendentes de PMF a travez de la ATP Synthase.
El primer sitio activo, o sitio de admisión, recibe ADP y radicales fosfato. El sitio de compresión inserta mediante ataque nucleofílico el fosfato en la molécula de ADP para generar ATP, y finalmente en el sitio de expulsión el ATP se libera al citoplasma quedando a disposición de los procesos bioquímicos celulares, y en particular a las cadenas fotosintéticas no dependientes de la luz, que en el caso de las bacterias púrpura, corresponden al ciclo de Calvin-Benson.
Esta enzima no es exclusiva de las bacterias púrpura, y está presente prácticamente en todos los organismos vivientes, desde arqueas hasta plantas superiores y animales, y siempre su función es la síntesis de ATP, utilizando el gradiente electroquímico de protones H+ , aunque en algunos casos también utiliza el gradiente de iones Na+ (Fuerza Sodio-motriz) , y raramente K+.
6. SÍNTESIS DE NADPH – NADH
Como se ilustró en la Fig.16., el centro de reacción P870 característico de bacterias púrpura NO es lo suficientemente reductor para reducir directamente NAD⁺, de modo que se debe contar con una maquinaria adicional para producirla.
Existen varias rutas reductoras principales:
- NADPH vía electrones provenientes de Cyt bc1:
Por esta ruta, parte de los electrones provenientes de Cyt bc1 via complejo de Rieske no retroalimentan RC sino que son redireccionados a Fdox para su reducción:
Fdox +e– → Fdred
A continuación, la enzima FNR (ferrodoxina-NADP+ reductasa), cataliza la reacción
Fdored + NADP+ + H+ → Fdox + NADPH
- NADH vía Electrones provenientes de donores orgánicos (Succinato, lactato):
En esta ruta, dado el bajo poder reductor de la maquinaria fotosintética y alto potencial Redox del par NAD+/NADH, se habilita el complejo II (Complejo SDH) de la máquinaria respiratoria (Succinato deshidrogenasa), permitiendo que succinato (o lactato) reduzcan quinonas a ser redireccionadas no hacia Cyt bc1 sino hacia el complejo I de la cadena respiratoria. Utilizando ATP-asa (ATP-Sinthase inversa) se incrementa el gradiente protónico en el espacio periplasmático lo que genera un flujo protónico inverso que a su vez permite que los electrones fluyan “Up Stream” en la cadena de ferrodoxinas hasta finalmente reducir NAD+. Ver Fig.17. Este proceso ocurre en obscuridad, de manera que el aparato fotosintético (módulos en gris en la figura) permanecen inactivos. Con propositos comparativos se anexa como Fig.18 el complejo fotosintético previamente presentado en la Fig 4. Vale la pena resaltar la función de “Switch” o conmutador de energia de l complejo II, el cual no solo alimenta alternativamente el Complejo I en la síntesis de NADH o el pool de quinonas en el proceso fotosintético sino que también invierte el flujo protónico, convirtiendo ATP-Synthase en ATP-Asa, forzando a un flujo protónico de citoplasma a pariplasma, y tambien invirtiendo este flujo en el complejo I, lo que finalmente lleva a sintetizar (y no consumir) NADH.

Figura 17. Síntesis de NADH en bacterias púrpura fotosintéticas via complejos de la cadena respiratoria.

Figura 18. Diagrama de flujo reacciones fotosintéticas dependientes de la luz en bacterias púrpura
- NADPH vía transhidrogenasas.
Las transhidrogenasas son enzimas que transfieren hidruros (H⁻) entre NADH y NADP⁺ para producir NADPH, siendo en la práctica un intercambio de poder reductor entre estos dos cofactores:
NADH + NADP+ ↔ NAD+ + NADPH
Esta ruta es particularmente útil cuando:
- Hay exceso de NADH (por respiración o metabolismo de sustratos orgánicos).
- Hay demanda de NADPH para biosíntesis (fijación de CO₂ cia CBB, síntesis de lípidos, etc).
REACCIONES NO DEPENDIENTES DE LA LUZ
En bacterias púrpura, al igual que en cyanobacterias y plantas superiores, el ciclo de Calvin-Benson es el receptor de facto del ATP producido en la fotosíntesis. Este ciclo forma parte integral de la maquinaria fotosintética, y corresponde a lo que se denomina reacciones no dependientes de la luz.
El ciclo de Calvin-Benson merece una lectura aparte, luego no se detalla en el presente blog.

Copyright
All rigths reserved
